Natriumbromid (NABR)
- 1934
- 215
- Per Karlsson
Vad är natriumbromid?
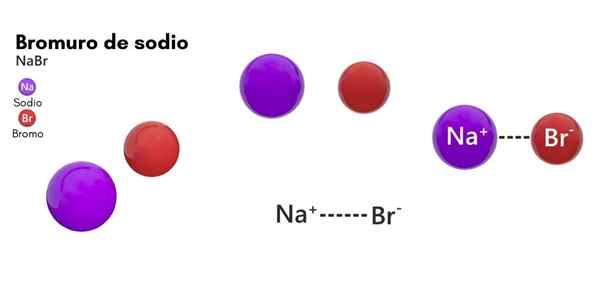
han natriumbromid Det är en kemisk art som tillhör salterna av oorganiskt ursprung. Dess struktur består av bromhalogenen och det natriummetalliska elementet i 1: 1. Dess kemiska formel är nabab och är i ett tillstånd av fast aggregering i standardtemperaturförhållanden (25 ° C och 1 atm).
Normalt kan det observeras som ett vitt damm och betraktas som en kristallin typförening som också manifesterar ett hygroskopiskt beteende; det vill säga det har förmågan att absorbera fukt från omgivningen.
På liknande sätt har natriumbromid fysiska egenskaper som mycket liknar en annan jonisk förening av samma metall: natriumklorid. Denna klorid representeras som NaCl, som oftare kallas vanligt salt eller bordsalt.
Det har ett stort antal användningsområden inom olika vetenskapsområden; Till exempel används det vid produktion av olika typer av läkemedel (lugnande medel, hypnotika, antikonvulsiva, bland andra), som i organisk syntes och till och med i fotograferingsapplikationer.
Kemisk struktur
Natriumbromid presenteras i en solid fas och, som många andra salter av oorganisk natur, har den en kristallin strukturell konformation.
Denna kristallina molekyl, bestående av en brom och en av väte, har en kubisk konformation centrerad på ansikten, såsom haloidtypsalter av samma metall (NAI, NAF och NaCl).
Detta molekylära arrangemang utgör den strukturella grunden för många föreningar, där ordningen utförs så att varje jon upprätthålls i mitten av en oktaedral figur, som visas i följande bild.
Kan tjäna dig: fosforsyra (H3PO3)
I den här typen av glas kan du se hur var och en av jonerna har runt det ytterligare sex joner - som har en motsatt elektrisk laddning - som ligger i ändarna av oktaedralen.
På samma sätt innebär strukturen för denna joniska substans att den har en hög smältpunkt på cirka 747 ° C, som är kommersiellt i dess två former: en vattenfri art (utan vattenmolekyler) och en dihydratiserad art (med två vattenmolekyler i dess strukturella formel (NABR · 2h2O)), vars sammanslagningspunkter är olika.
Kemisk syntes
Natriumbromid härstammar genom den kemiska reaktionen som uppstår mellan vätebromid (BRH, en vätehalogenid i gasfasen) och natriumhydroxid (NaOH, en stark bas i fast fas och med hygroskopiska egenskaper).
På detta sätt tillverkas det kommersiellt och lägger till ett överskott av brom till en NaOH -lösning. Således bildas en bromid/brominblandning. Därefter utsätts de resulterande produkterna för indunstning tills de är torra och behandlas med kol för att generera reaktionen av bromatjon (bro3-) till bromidjonen (Br-).
Neutralisering
På liknande sätt kan detta oorganiska salt också uppstå genom en natriumkarbonatneutraliseringsreaktion (NA2Co3) Med bromsyra (Hbro3), enligt samma procedur som beskrivs ovan.
Genom en syntes kan detta ämne produceras genom reaktionen mellan järn med brom och vatten. Som en produkt av denna reaktion härstammar den järnhaltiga bromidarten.
Kan tjäna dig: alkoholerDärefter bildades denna art (representerad som februari2/Februari3) är upplöst i vatten och en viss mängd natriumkarbonat tillsätts. Slutligen filtreras lösningen och passerar genom en förångningsprocess för att få natriumbromiden äntligen.
Natriumbromidegenskaper
- Det är vanligtvis i ett tillstånd av fast aggregering, i form av vitt damm.
- Den har en kristallin struktur, med en molekylär ordning i form av kub centrerad på ansikten.
- Smältpunkten för detta ämne är ungefär 747 ° C för vattenfri och 36 ° C -form för dess dihydratform och presenterar nedbrytning innan den smälter.
- Den består av en natriumjon (NA+) och en bromidjon (Br-), med en molmassa eller molekylvikt på 102,89 g/mol.
- Kokpunkten är ganska hög och observerar 1390 ° C (motsvarande 2530 ° F eller 1660 K).
- Lösligheten för denna art är cirka 94,32 g/100 ml i vatten vid 25 ° C, vilket ökar när temperaturen ökar.
- Genom att genomgå uppvärmning till den punkt där den bryts ned, släpper detta ämne bromigaser och natriumoxid anses giftig.
- Densiteten för den vattenfria formen av natriumbromid är 3,21 g/cm3, Medan den dihydratiserade föreningen är 2,18 g/cm3.
- Dess löslighet i alkohol betraktas som måttlig, som i andra lösningsmedel som pyridin, ammoniak och hydraktion.
- Det presenterar olöslighet mot acetonitril och aceton.
Användning/applikationer
- I det medicinska området används det som ett läkemedel för ett stort antal tillstånd som har sitt ursprung i anfall och som terapi för att förhindra epilepsibilder hos patienter med varg-hirschhornsyndrom, såväl som lugnande och hypnotiska behandlingar.
Det kan tjäna dig: Brominsyra (HBRO3): Egenskaper, risker och användningar- I veterinärmedicin används det hos hundar som har krampaktiga störningar på grund av biverkningarna av läkemedel som primidon eller fenobarbital.
- Inom oljeindustrins fält används det i processerna för beredning av vissa vätskor med varierad densitet som används i oljebrunnar.
- Inom området biologisk forskning har dess mikrobiocidala egenskaper bevisats; Det vill säga det används för att kontrollera utvecklingen av olika typer av bakterier.
- I viss syntes av organisk typ används detta oorganiska salt för framställning av andra arter som består av Bromo. Till exempel, genom Finkelsteins reaktion, erhålls vissa reaktivitet alkylhalogenider, varav en brukade vara ganska använd i fotografering.
- I rengörings- och desinfektionsområdet används natriumbromid i kombination med klor för sanitet av stora volymer vatten, som i simbassänger och jacuzzis.