Buteno

- 1845
- 538
- Johan Olsson
 Buutens kemisk struktur
Buutens kemisk struktur Vad är Buteno?
han Buteno Det är namnet som får en serie på fyra isomerer med kemisk formel C4H8. De är alkener eller olefiner, det vill säga de har en dubbelbindning c = c i sin struktur. Dessutom är de kolväten, som finns i oljeavlagringar eller har sitt ursprung genom termisk sprickor och erhåller produkter med lägre molekylvikt.
De fyra isomererna reagerar med syre som släpper ut värme och en gul låga. De kan också reagera med ett brett spektrum av små molekyler som läggs till i deras dubbelbindning.
Men vad är Butenos isomerer? I den övre bilden representeras strukturen med vita sfärer (hydrogener) och svarta (kol) för 1-butenen. 1-butenen är den enklaste isomeren av kolvätet C4H8.
Observera att det finns åtta vita sfärer och fyra svarta sfärer, vilket överensstämmer med den kemiska formeln.
De andra tre isomererna är cis och trans 2-buten och iso-buten. Alla uppvisar mycket liknande kemiska egenskaper, även om deras strukturer orsakar variationer i fysiska egenskaper (fusions- och kokpunkter, tätheter etc.).
Dessutom har deras spektra IR liknande mönster av absorptionsband.
Sammanfattningsvis heter 1-buten som Buteno, även om 1-buten endast hänvisar till en enda isomer och inte ett generiskt namn. Dessa fyra organiska föreningar är gaser, men kan vara flytande till högt tryck eller kondens.
De är en källa till värme och energi, reagens för syntes av andra organiska föreningar och framför allt nödvändigt för tillverkning av konstgummi efter syntesen av butadien.
Fysiska och kemiska egenskaper hos Buteno
Molekylvikt
56.106 g/mol. Denna vikt är densamma för alla isomerer i formel c4H8.
Fysiska aspekter
Det är en färglös och brandfarlig gas (som de andra isomererna) och har en relativt aromatisk lukt.
Kokpunkt
Kokpunkterna för Buteno -isomerer är följande:
1 -Buten: -6º C
CIS-2-buten: 3.7: e c
Trans-2-buten: 0.96º C
2 -metylpropen: -6.9º C
Smältpunkt
1 -Buten: -185.3: e c
CIS-2-buten: -138.9º C
Trans-2-buten: -105.5: e c
2 -MetylPropeno: -140.4: e c
Löslighet
Buteno är mycket olöslig i vatten på grund av dess apolära natur. Men det upplöses perfekt i vissa alkoholer, till exempel bensen, toluen och etrar.
Densitet
0.577 till 25 ° C. Därför är det mindre tätt än vattnet och i en behållare skulle det vara beläget över samma.
Reaktivitet
Liksom alla alken är dess dubbelbindning mottaglig för tillsats av molekyler eller oxiderande. Detta gör Buteno och dess isomerer reaktiva. Å andra sidan är de brandfarliga ämnen, så innan ett överskott av temperaturen reagerar de med syre i luften.
Kan tjäna dig: butanal: struktur, egenskaper, användningar och riskerBuutens kemisk struktur
I den övre bilden representeras strukturen för 1-buten. Till vänster kan du se platsen för dubbelbindningen mellan det första och det andra kolet.
Molekylen har en linjär struktur, även om regionen runt C = C -länken är platt på grund av SP -hybridisering2 av dessa kolhydrater.
Om 1-butenmolekylen vändes i en vinkel på 180º, skulle samma molekyl inte ha några uppenbara förändringar, därför saknar den optisk aktivitet.
Hur skulle dina molekyler interagera? C-H, C- och C-C-länkar är apolär natur, så ingen av dem samarbetar i bildandet av ett dipolmoment.
Följaktligen Cho -molekyler2= Chch2Ch3 De måste interagera genom London Dispersion Forces.
Den högra änden av butenen bildar omedelbar dipol, som på kort avstånd polariserar de intilliggande atomerna i en angränsande molekyl. Å andra sidan, den vänstra änden av länken C = C, interagerar överlappande molnen π ovanpå den andra (till exempel två skivor eller ark).
Eftersom det finns fyra kolatomer som komponerar molekylskelettet är dess interaktioner knappast tillräckligt för att vätskefasen ska ha en kokpunkt på -6 ° C.
Konstitutionella och geometriska isomerer
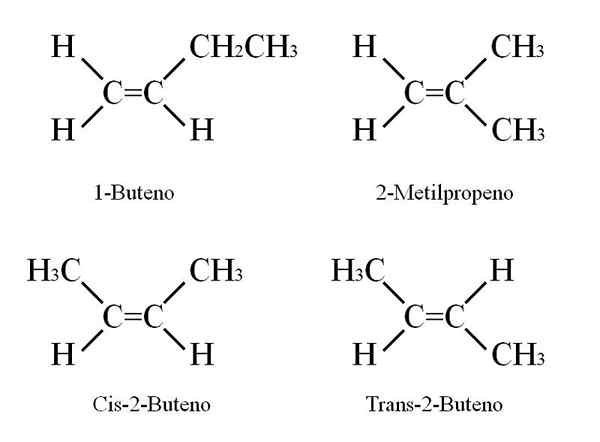 Butenous strukturer. Källa: Gabriel Bolívar
Butenous strukturer. Källa: Gabriel Bolívar 1-butenen har en molekylformel c4H8; Men andra föreningar kan ha i sin struktur samma andel atomer av C och H.
Hur är det möjligt? Om strukturen för 1-buten observeras noggrant, kan kolsubstituenter C = C utbyts. Detta utbyte producerar andra föreningar från samma skelett.
Dessutom kan dubbelbindningspositionen mellan C-1 och C-2 gå mot C-2 och C-3: CH3Ch = chch3, 2-buten.
I 2-buten kan H-atomer placeras på samma sida av dubbelbindningen, vilket motsvarar cis-stereoisomeren; eller i en motsatt rumslig orientering, i trans -stereoisomeren. Båda utgör vad som också kallas geometriska isomerer. Detsamma gäller för grupper -ch3.
Observera på samma sätt att om det är kvar i Cho's molekyl3Ch = chch3 H -atomerna på ena sidan och CH -grupperna3 I en annan skulle en konstitutionell isomer erhållas: Ch2= C (ch3)2, 2-metylpropen (även känd som iso-buten).
Kan tjäna dig: kaliumnitrat (KNO3)Dessa fyra föreningar har samma formel C4H8 Men olika strukturer. 1-buten och 2-metylpropen är konstitutionella isomerer; och CIS och trans-2-buten, geometriska isomerer mellan dem två (och konstitutionella med avseende på resten).
Stabilitet
Förbränningsvärme
Från den övre bilden, vilken av de fyra isomererna som representerar den mest stabila strukturen? Svaret kan till exempel hittas i förbränningsvärmen för var och en av dem.
När du reagerar med syre, isomeren med formel C4H8 förvandlas till CO2 Släpp vatten och värme:
C4H8(g) + 6o2(g) => 4co2(g) + 4h2O (g)
Förbränning är exoterm, så ju mer värme släpps, desto mer instabil är kolväte. Därför kommer den av de fyra isomererna som släpper mindre värme för att bränna i luften, vara den mest stabila.
Förbränningen för de fyra isomererna är:
-1-buten: 2717 kJ/mol
-CIS-2-buten: 2710 kJ/mol
-Trans-2-buten: 2707 kJ/mol
-2-metylpropeno: 2700 kJ/mol
Observera att 2-metylpropen är isomeren som avger mindre värme. Medan 1-buten är den som släpper ut mest värme, vilket innebär större instabilitet.
Sterisk och elektronisk effekt
Denna stabilitetsskillnad mellan isomerer kan dras direkt från den kemiska strukturen.
Enligt Alkenes förvärvar den som har de mest substituenterna större stabilisering av hans dubbelbindning. Således är 1-butenen den mest instabila eftersom den knappt har en substituent (-ch2Ch3); det vill säga det är monosustuido (rhc = cho2).
Cis och transisomerer i 2-butenen skiljer sig åt i energi på grund av spänningen på van der vägg som härstammar från den steriska effekten.
I cis -isomeren, de två grupperna ch3 På samma sida av dubbelbindningen avvisar de varandra, medan dessa i transisomeren är tillräckligt avlägsna från varandra.
Men varför är 2-metylpropen den mest stabila isomeren? Eftersom den elektroniska effekten intercedes.
I det här fallet, även om det är en upplöst alken, de två CH -grupperna3 De är i samma kol; i en geminal position angående den andra.
Dessa grupper stabiliserar dubbelbindningen kol som ger det en del av deras elektroniska moln (eftersom det är relativt surare genom att ha SP -hybridisering2).
Dessutom har dess två isomerer i 2-butenen bara andra kol; Medan 2-metylpropen innehåller ett tredje kol med större elektronisk stabilitet.
Kan tjäna dig: Struktur av material: Koncept och exempelIntermolekylära krafter
Stabiliteten hos de fyra isomererna följer en logisk ordning, men detsamma händer inte med intermolekylära krafter. Om deras smält- och kokpunkter jämförs kommer de att upptäcka att de inte följer samma ordning.
Det kan förväntas att trans-2-buten kommer att presentera de största intermolekylära krafterna för att ha större ytkontakt mellan två molekyler, till skillnad från CIS-2-buten, vars skelett drar en C. Cis-2-buten kokar emellertid vid en högre temperatur (3.7: e c), att transisomeren (0.96º C).
De liknande kokpunkterna för 1-buten och 2-metylpropen kan förvänta sig dem eftersom de är strukturellt mycket lika. Men i fast tillstånd förändras skillnaden radikalt. 1 -butenen smälter till -185.3º C, medan 2 -metylpropen vid -140.4: e c.
Dessutom smälter cis-2-butenisomeren till -138.9º C, vid en temperatur mycket nära 2-metylpropen, vilket kan innebära att de i det fasta ämnet har ett lika stabilt arrangemang.
Från dessa data kan man dra slutsatsen att trots att de känner till de mest stabila strukturerna kastar de inte tillräckligt med ljus i kunskapen om hur intermolekylära krafter fungerar i vätskan; Och ännu mer, i den fasta fasen av dessa isomerer.
Butenus använder
-Butenier, med tanke på deras förbränningsvärme, kan helt enkelt användas som värme eller bränslekälla. Således kan man förväntas att lågan med 1-buten varm mer än de andra isomererna.
-De kan användas som organiska lösningsmedel.
-De fungerar som tillsatser för att höja nivån på oktan av bensin.
-Inom den organiska syntesen deltar 1-butenen i produktionen av andra föreningar såsom: butylenoxid, 2-glutanol, succinimida och terbutilmecaptano (används för att ge köksgasen sin karakteristiska lukt).
Från Butene -isomererna kan du också få Butadieno (Cho2= Ch-ch = ch2), av vilket konstgjort gummi syntetiseras.
Utöver denna syntes kommer mångfalden av produkterna att bero på vilka molekyler som läggs till dubbelbindning.
Till exempel kan alkylhalider syntetiseras om de reageras med halogener; Alkoholer, om de tillsätt vatten i ett surt medium; och tredje butiker om de lägger alkoholer med låg molekylvikt (som metanol).
Referenser
- Francis A. Sköldpaddsskal. Organisk kemi. Karboxylsyror (sjätte upplagan, sidan 863-866). MC Graw Hill.
- Wikipedia (2018). Buteno. Taget från: det är.Wikipedia.org
- YPF (juli). Butenier. [Pdf]. Taget från: ypf.com
- William Reusch (2013). Tilläggsreaktioner från alkes. Återhämtad från: 2.Kemi.Msu.Edu
- Pubchem (2018). 1-buten. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov

