Värmeabsorberade formler, hur man beräknar den och lösta övningar

- 4072
- 429
- Erik Eriksson
han absorberad värme Det definieras som överföring av energi mellan två kroppar vid olika temperaturer. Den med lägre temperatur absorberar värmen än vid en högre temperatur. När detta händer ökar den termiska energin i ämnet som absorberar värmen, och partiklarna som komponerar den vibrerar snabbare och höjer sin kinetiska energi.
Detta kan översätta till en temperaturökning eller en statlig förändring. Flytta till exempel från fast till vätska, till exempel is när det smälter i kontakt med vatten eller läsk vid rumstemperatur.
 Metallteskeden absorberar varm kaffevärme. Källa: Pixabay.
Metallteskeden absorberar varm kaffevärme. Källa: Pixabay. Tack vare värme är det också möjligt att objekt ändrar sina dimensioner. Termisk dilatation är ett bra exempel på detta fenomen. När de flesta ämnen värms upp, upplever de vanligtvis en ökning av deras dimensioner.
Ett undantag från detta är vatten. Samma mängd flytande vatten ökar volymen när den kyls under 4 ºC. Dessutom kan temperaturförändringar också uppleva förändringar på nivån på deras densitet, något också mycket observerbart när det gäller vatten.
[TOC]
Vad är och formler
När det gäller energi i transit är enheterna för värmen som absorberas Joules. Men under lång tid hade värmen sina egna enheter: kalorin.
Fortfarande i dag används denna enhet för att kvantifiera matens energiinnehåll, även om en matkalori i verkligheten motsvarar en kilokalori av värme.
Kalorier
Kalorin, förkortad som kalk, Det är den mängd värme som krävs för att höja temperaturen på 1 gram vatten med 1 º C.
Under 1800 -talet genomförde Sir James Prescott Joule (1818 - 1889) ett berömt experiment där han lyckades omvandla mekaniskt arbete till värme och få följande ekvivalens:
1 kalori = 4.186 Joules
I brittiska enheter kallas värmeenheten BTU (Brittisk termisk enhet), vilket definieras som mängden värme som behövs för att höja temperaturen på ett kilo vatten i 1 ºF.
Det kan tjäna dig: kalibreringskurva: vad är det för, hur man gör det, exempelEkvivalensen mellan enheter är som följer:
1 BTU = 252 kalorier
Problemet med dessa gamla enheter är att mängden värme beror på temperaturen. Det vill säga, det är inte detsamma som krävs för att passera från 70 ºC till 75 ° C än den som krävs för att värma vattnet från 9 ° C till 10 ºC, till exempel.
Det är därför definitionen överväger väldefinierade intervaller: 14.5 till 15.5 ° C och 63 till 64 ° F för kalori respektive BTU.
Vad som beror på mängden som absorberas värme?
Mängden absorberad värme som samlar in ett material beror på flera faktorer:
- Massa. Ju högre massa, desto mer värme kan den absorbera.
- Ämnesegenskaper. Det finns ämnen som beroende på deras molekylära eller atomstruktur kan ta upp mer värme än andra.
- Temperatur. Det krävs att lägga till mer värme för att få en högre temperatur.
Mängden värme, betecknad som Q, Det är proportionellt mot de beskrivna faktorerna. Därför kan du skriva som:
Q = m.c.ΔT
Var m Det är objektets massa, c är en konstant som kallas specifik värme, en inneboende egenskap hos ämnet och 5T Det är temperaturvariationen som uppnås genom att absorbera värme.
ΔT = TF - Tantingen
Denna skillnad har ett positivt tecken, eftersom när absorberande värme kan förväntas det TF > Tantingen. Detta händer om inte ämnet upplever en fasförändring, till exempel vatten när ångvätskan passerar. När vattnet kokar förblir temperaturen konstant vid cirka 100 º C, oavsett hur snabbt det kokar.
Hur man beräknar det?
Genom att kontakta två objekt vid en annan temperatur, efter ett tag når de båda den termiska jämvikten. Så temperaturen utjämnas och värmeöverföring upphör. Detsamma händer om mer än två föremål är i kontakt. Efter en viss tid kommer alla att ha samma temperatur.
Det kan tjäna dig: Magnetisering: Orbital och snurrmagnetiskt ögonblick, exempelAntagande att objekt i kontakt bildar ett stängt system, från vilket värme inte kan fly, principen om energibesparing tillämpas, så det kan bekräftas att:
Q absorberad = - Q Sken
Detta representerar en energibalans, liknande den för en persons ingångar och utgifter. Det är därför den cedade värmen har ett negativt tecken, eftersom för objektet som ger den slutliga temperaturen är lägre än den initiala. Därför:
ΔT = TF - Tantingen < 0
Ekvationen q absorberad = - Q Sken Det används när två objekt är i kontakt.
Energibalansen
För att utföra energibalansen är det nödvändigt att skilja de objekt som absorberar värme från de som ger, sedan:
Σ qk= 0
Det vill säga summan av energibelopp och förluster i ett stängt system måste vara lika med 0.
Det specifika värmen i ett ämne
För att beräkna mängden absorberad värme måste du känna till den specifika värmen för varje deltagande ämne. Detta är mängden värme som behövs för att höja temperaturen på 1 g material med 1 º C. Dess enheter i det internationella systemet är: Joule/kg . K.
Det finns tabeller med den specifika värmen för många ämnen, vanligtvis beräknade genom att använda en kalorimeter eller liknande verktyg.
Ett exempel på hur man beräknar ett materials specifika värme
250 kalorier krävs för att höja temperaturen på en metallring på 20 till 30 ºC. Om ringen har en massa på 90 g. Vad är den specifika värmevärmen i SI -enheter?
Lösning
Enheterna konverteras först:
F = 250 kalorier = 1046.5 J
m = 90 g = 90 x 10-3 kg
Kan tjäna dig: Elastiska chocker: I en dimension, specialfall, övningar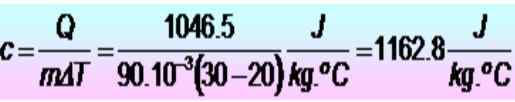
Träning löst
En aluminiumkopp innehåller 225 g vatten och en 40 g koppar agitator, alla vid 27 ° C. Ett prov på 400 g silver vid en initial temperatur på 87 ° C placeras i vattnet.
Omröraren används för att rör om blandningen tills den når sin slutliga jämviktstemperatur på 32 ° C. Beräkna massan på aluminiumkoppen med tanke på att det inte finns några värmeförluster mot miljön.
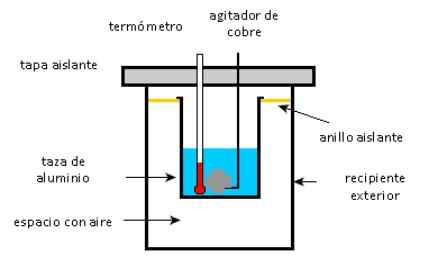 Kalorimeter. Källa: Solidswiki.
Kalorimeter. Källa: Solidswiki. Närma sig
Som nämnts ovan är det viktigt att skilja föremålen som ger värme från de som absorberar:
- Aluminiumkopp-, koppar- och vattenrörare absorberar värme.
- Silverprovet ger värme värmen.
Data
De specifika värmarna för varje ämne levereras:
- Silver: C = 234 J/kg. ºC
- Koppar: c = 387 j/kg. ºC
- Aluminium C = 900 J/kg. ºC
- Vatten C = 4186 J/kg. ºC
Värmen som absorberas eller tilldelas av varje ämne beräknas genom ekvation:
Q = m.c.λT
Lösning
Silver
Q Sken = 400 x 10 -3 . 234 x (32 - 87) j = -5148 j
Övertagare
Q absorberad = 40 x 10 -3 . 387 x (32 - 27) j = 77.4 J
Vatten
Q absorberad = 225 x 10 -3 . 4186 X (32 - 27) J = 4709.25 J
Aluminiumkopp
Q absorberad = m aluminium . 900 x (32 - 27) j = 4500 .m aluminium
Att använda:
Σ qk= 0
77.4 + 4709.25 + 4500 .m aluminium = - (-5148)
Slutligen rensas aluminiummassan:
m aluminium = 0.0803 kg = 80.3 g
Referenser
- Giancoli, D. 2006. Fysik: Principer med applikationer. 6th. Ed. Prentice hall. 400 - 410.
- Kirkpatrick, l. 2007. Fysik: En titt på världen. 6ta Förkortad upplaga. Cengage Learning. 156 - 164.
- Rex, a. 2011. Fysikens grunder. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysik med modern fysik. 14th. Volym 1. 556 - 553.
- Serway, R., Vule, c. 2011. Fysikens grunder. 9na Cengage Learning. 362 - 374

