Ammoniumkarbonat ((NH4) 2CO3)
- 4457
- 768
- PhD. Emil Svensson
Vad är ammoniumkarbonat?
han Ammoniumkarbonat Det är ett oorganiskt kvävesalt, särskilt ammoniak, vars kemiska formel är (NH4)2Co3. Det utarbetas av syntesmetoder, bland vilka det är värt att använda sublimeringen av en blandning av ammoniumsulfat och kalciumkarbonat: (NH4)2Sw4(S)+ Caco3(S) => (NH4)2Co3(S)+ fall4(S).
Generellt upphettas ammoniumsalter och kalciumkarbonat i en behållare för att orsaka ammoniumkarbonat. Den industriella metoden som producerar massor av detta salt är att passera koldioxid genom en absorptionskolonn som innehåller en lösning av ammonium i vatten och sedan utför en destillation.
Ångorna som innehåller ammonium, koldioxid och vatten kondenseras för att bilda ammoniumkarbonatkristaller: 2NH3(g)+ h2Eller (l) + co2(g) → (NH4)2Co3(S). I reaktionen inträffar kolsyran, h2Co3, Efter att ha upplöst koldioxid i vattnet, och det är denna syra som ger sina två protoner, h+, till två ammoniakmolekyler.
Ammoniumkarbonategenskaper
 Utseende av ammoniumkarbonat
Utseende av ammoniumkarbonat Det är en vit, kristallin och färglös fast, med starka dofter och ammoniaksmaker. Smälter till 58 °.
Emellertid inträffar denna nedbrytning i två steg: först släpps en NH -molekyl3, producerar ammoniumbikarbonat (NH4Hco3); Och för det andra, om uppvärmningen fortsätter, är karbonat oproportionerligt.
Det är en solid löslig i vatten och mindre lösligt i alkoholer. Forma vätebroar med vatten, och när 5 gram upplöses i 100 gram vatten genererar den en grundläggande lösning med ett pH runt 8.6.
Kan tjäna dig: Emulgifiering: Emulsionsprocess, molekylära aspekter, applikationerDess höga affinitet för vatten tillverkas av ett hygroskopiskt fast ämne (det absorberar fukt), och det är därför det är svårt att hitta det i sin anhydridform. Faktum är att dess monohydratform (NH4)2Co3· H2O), är den vanligaste av alla och förklarar hur salt är en bärare av ammoniakgas, vilket orsakar lukt.
I luften bryts det ner för att generera ammoniumbikarbonat och ammoniumkarbonat (NH4Nh2Co2).
Kemisk struktur
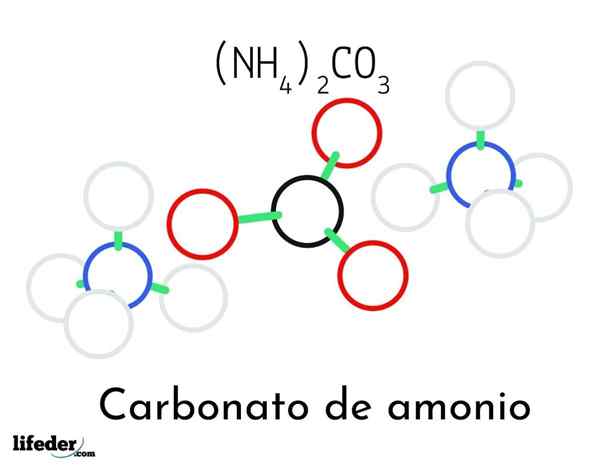
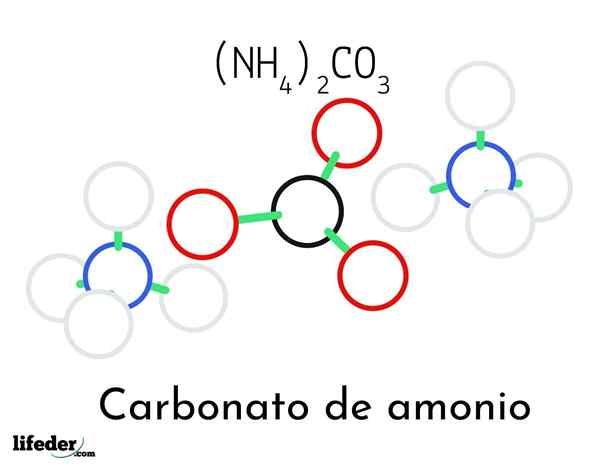
 Ammoniumkarbonatstrukturmodell; Två ammonium- och en karbonatkatjoner
Ammoniumkarbonatstrukturmodell; Två ammonium- och en karbonatkatjoner I den överlägsna bilden illustreras den kemiska strukturen hos ammoniumkarbonat. I mitten är anjonen Co32-, den platta triangeln med det svarta mitten och de röda sfärerna; Och till dess två sidor, ammonios NH -katjoner4+ med tetraedrala geometrier.
Ammoniumjongeometri förklaras av SP -hybridisering3 av kväveatomen, beställer väteatomerna (de vita sfärerna) runt den i form av en tetrahedron. Bland de tre jonerna etableras av vätebroar (h3N-h- o-co22-).
Tack vare dess geometri, en enda co -aning32- kan bilda upp till tre vätebroar; Medan NH -katjoner4+ Kanske kan de inte bilda sina motsvarande fyra vätebroar på grund av de elektrostatiska avstötningarna bland deras positiva laddningar.
Resultatet av alla dessa interaktioner är kristallisationen av ett ortorrombiskt system. Varför är det så hygroskopiskt och vattenlösligt? Svaret är i samma föregående stycke: vätebroar.
Dessa interaktioner är ansvariga för snabb vattenabsorption av anhydridsalt som ska bildas (NH4)2Co3· H2ANTINGEN). Detta resulterar i förändringar i det rumsliga arrangemanget av jonerna, och därför i den kristallina strukturen.
Det kan tjäna dig: nickelklorid (NICL2): Struktur, egenskaper, erhållning, användningStrukturella nyfikenheter
Oavsett hur enkelt (NH ser ut4)2Co3, Det är så känsligt för otaliga omvandlingar att dess struktur är ett mysterium som skickas till den verkliga sammansättningen av det fasta ämnet. Denna struktur varierar också beroende på de tryck som påverkar kristallerna.
Vissa författare har funnit att joner beställs som coplanarer fodrade av vätebroar (det vill säga en kedja med en NH -sekvens4+-Co32--...) där vattenmolekyler antagligen fungerar som kontakter till andra kedjor.
Ännu mer, överskrider markhimlen, hur är dessa kristaller i rumsliga eller interstellära förhållanden? Vilka är dina kompositioner när det gäller stabiliteten hos kolsyrade arter? Det finns studier som bekräftar den stora stabiliteten hos dessa kristaller fångade i planetariska och kometer ismassor.
Detta gör att de kan tjäna som kol-, kväve- och vätereserver, som får solstrålning kan förvandlas till organiskt material såsom aminosyror.
Det vill säga dessa glass ammoniska block kan vara bärare av "The Wheel som startar livets maskiner" i kosmos. Av dessa skäl ökar deras intresse för astrobiologi och biokemi.
Användning/applikationer
Det används som en leuers, eftersom uppvärmningen producerar koldioxid och ammoniumgaser. Ammoniumkarbonat är, om du vill, en föregångare till modernt bakpulver och kan användas för att baka kakor och platta kex.
Men dess användning för att baka kakor rekommenderas inte. På grund av tjockleken på kakorna bibehålls ammoniumgaserna inuti och ger en obehaglig smak.
Det kan tjäna dig: Cyclohexen: Struktur, egenskaper, syntes och användningarDet används som en slemhjälpare, det vill säga, lindrar hosta när de avgick bronkierna. Det har fungicidåtgärd, av detta skäl inom jordbruket. Det är också en regulator för den surhet som finns i maten och används i organisk urea -syntes i högt tryck, och Hidantoinas.
Risker
Ammoniumkarbonat är mycket giftigt. Det producerar hos människor en akut irritation av munhålan när du sätter i kontakt.
Dessutom, om intaget orsakar gastrisk irritation. En liknande verkan observeras i ögonen utsätts för ammoniumkarbonat.
Inandning av saltnedbrytningsgaser, kan irritera näsan, halsen och lungorna, vilket orsakar hosta och andningsbesvär.
Akut exponering för hund på ammonat ammonat i en dos av 40 mg/kg vikt, orsakar kräkningar och diarré. De högsta doserna av ammoniumkarbonat (200 mg/kg vikt) är vanligtvis dödliga. Hjärtskador indikeras som dödsorsaken.
Om den värms upp vid mycket höga temperaturer och i en luft berikad med syre, avger den giftiga gaser2.
Referenser
- Pub. (2018). Ammoniumkarbonat. Hämtad 25 mars 2018 från PubChem: PubChem.Ncbi.Nlm.Nih.Gov
- Organisk kemi portal. ((2009-2018)). Bucherer-Bergs-reaktion. Hämtad 25 mars 2018 från Organic Chemistry Portal: www.Organisk kemi.org
- Wikipedia. (2018). Ammoniumkarbonat. Hämtad den 25 mars 2018 från Wikipedia: In.Wikipedia.org
- Det kemiska företaget. (2018). Det kemiska företaget. Hämtad 25 mars 2018 från The Chemical Company: TheChemco.com