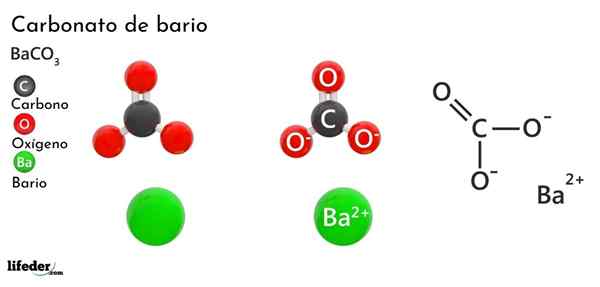
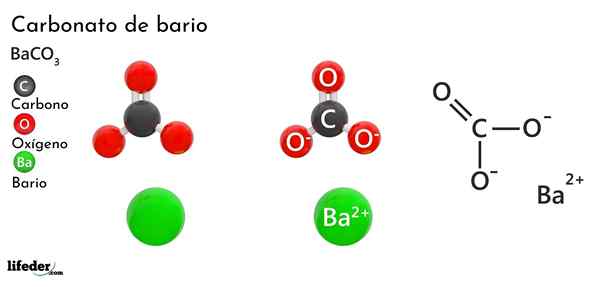
Bariumkarbonat (BACO3)
- 3925
- 206
- Hans Olsson
Vad är bariumkarbonat?
han bariumkarbonat Det är ett oorganiskt salt av metallbario, näst sista element i grupp 2 i det periodiska tabellen och som tillhör de alkalinoterösa metallerna. Dess kemiska formel är Bacchus3 Och det finns tillgängligt på marknaden i form av vitt kristallint damm.
Hur erhålls det? Metallbarium finns i mineraler, såsom bariten (BASO4) och Whiterite (Bacchus3). Whiterite är associerad med andra mineraler som förblir renhetsnivåer till dess vita kristaller i utbyte mot färg.
För att generera Bacchus3 av syntetisk användning är det nödvändigt att eliminera vititernas föroreningar, vilket indikeras av följande reaktioner:
Bacchus3(s, oren) + 2nh4Cl (s) + q (värme) => bacl2(aq) + 2nh3(g) + h2Eller (l) + co2(g)
Bacl2(aq) + (NH4)2Co3(S) => Bacchus3(S) + 2NH4Cl (aq)
Barita är emellertid den viktigaste källan till barium, och det är därför industriproduktionerna av bariumföreningar börjar från detta. Denna mineral syntetiserar bariumsulfid (BA), en produkt från vilken syntesen av andra föreningar och bacchusflöden3:
Bas (s) + na2Co3(S) => Bacchus3(s) + na2H.H)
Bas (s) + co2(g) + h2Eller (l) => Bacchus3(S) + (NH4)2S (aq)
Bariokarbonategenskaper
 Bariumkarbonatstoft
Bariumkarbonatstoft Det är en dammig, vit och kristallin. Det är toalett, upptäckt och dess molekylvikt är 197,89 g/mol. Den har en densitet av 4,43 g/ml och ett icke -existerande ångtryck.
Den har brytningshastigheter på 1 529, 1 676 och 1 677. Witherita avger ljus när den absorberar ultraviolett strålning: från ett starkt vitt ljus med blåaktiga toner, till ett gult ljus.
Det är mycket olösligt i vatten (0,02 g/L) och i etanol. I HCl bildar syralösningar det lösliga bariokloridsaltet (BACL2), som förklarar dess löslighet i dessa sura media. När det gäller svavelsyra, fäller ut hur olöslig saltbas4.
Kan tjäna dig: Beryl Oxide (Beeo)Bacchus3(S) + 2HCl (AQ) => BACL2(aq) + co2(g) + h2Eller (l)
Bacchus3(s) + h2Sw4(aq) => Baso4(s) + co2(g) + h2Eller (l)
Eftersom det är ett joniskt fast ämne är det också olösligt i de apolära lösningsmedlen. Bariumkarbonatet smälter vid 811 ºC; Om temperaturen ökar runt 1380-1400 ºC lider den salta vätskan en kemisk sönderdelning istället för att koka. Denna process sker för alla metallkarbonater: MCO3(s) => mo (s) + co2(g).
Termisk nedbrytning
Bacchus3(s) => bao (s) + co2(g)
Om joniska fasta ämnen kännetecknas av att vara mycket stabila, varför bryter karbonater? Ändrar metallen temperaturen vid vilken de fasta delarna bryts ner? Jonerna som utgör bariumkarbonat är BA2+ och co32-, Båda skrymmande (det vill säga med stora joniska radioapparater). Kompaniet32- Han är ansvarig för nedbrytning:
Co32-(S) => O2-(g) + co2(g)
Oxidjonen (eller2-) Metall är kopplad till metall, metalloxid. MO genererar en ny jonisk struktur där, som en allmän regel, ju mer liknande storleken på dess joner är, desto stabilare är den resulterande strukturen (nätverksentalpi). Det motsatta händer om jonerna m+ Jag2- De har mycket ojämlika joniska radioapparater.
Om nätverksentalpin är stor är nedbrytningsreaktionen energiskt gynnad, vilket kräver lägre uppvärmningstemperaturer (lägre kokpunkter) mindre).
Å andra sidan, om MO har ett litet nätverksentalpi (som i fallet med BAO, där BA2+ Den har större jonisk radio än eller2-) Nedbrytning är mindre gynnad och kräver högre temperaturer (1380-1400 ° C). I MGCO -fall3, Tjuv3 och srco3, De bryter ner vid lägre temperaturer.
Kan tjäna dig: magnesium: historia, struktur, egenskaper, reaktioner, användningarKemisk struktur
Anjonen CO32- Den har en dubbelbindning som resonerar mellan tre syreatomer, två av dessa negativt laddade för att locka katjon BA2+.
Medan båda jonerna kan betraktas som laddade sfärer, CO32- Den har en platt trigonal geometri (den platta triangeln som ritas av de tre syreatomerna), som eventuellt är en negativ "pad" för BA2+.
Dessa joner interagerar elektrostatiskt för att bilda ett kristallint arrangemang av en ortorrhrombisk typ, är de övervägande jonbindningarna.
I så fall, varför är inte Bacchus löslig3 I vatten? Förklaringen är helt enkelt baserad på det faktum att joner är bättre stabiliserade i det kristallina nätverket än hydratiserat av sfäriska molekylära vattenskikt.
Från en annan vinkel gör vattenmolekyler det svårt att övervinna starka elektrostatiska attraktioner mellan de två jonerna. Inom dessa kristallina nätverk kan de hysa föroreningar som ger färg till sina vita kristaller.
Ansökningar
Vid första anblicken, en Bacchus -del3 Det kanske inte lovar någon praktisk tillämpning i det dagliga livet, men om det finns en kristall av det vitare mineral, börjar vit som mjölk, är vettigt varför dess ekonomiska efterfrågan.
Används för att tillverka bariumglas eller som ett tillsats för att stärka dem. Det används också vid tillverkning av optiskt glas.
På grund av dess stora nätverk och olöslighetsintalpi används den vid tillverkning av olika typer av legeringar, gummi, ventiler, golv, målningar, keramik, smörjmedel, plast, fetter och cement.
Det används också som gift för möss. Sammanfattningsvis används detta salt för att producera andra bariumföreningar och fungerar därmed som elektroniska enheter material.
Kan tjäna dig: sulfanylsyra: struktur, egenskaper, syntes, användningBacchus3 Det kan syntetiseras som nanopartiklar och uttrycker mycket små skalor Nya intressanta egenskaper hos Whiterite. Dessa nanopartiklar används för att genomsyra metallytor, särskilt kemiska katalysatorer.
Det har visat sig förbättra oxidationskatalysatorerna, och som på något sätt gynnar migrationen av syremolekyler vid ytan.
De betraktas som redskap för att påskynda de processer där syre är införlivade. Och slutligen används de för att syntetisera supramolekylära material.
Risker
Bacchus3 Det är giftigt på grund av intag, vilket orsakar en oändlighet av obehagliga symtom som leder till dödsfall på grund av andningsfel eller hjärtstopp; Av denna anledning rekommenderas det inte att transporteras bredvid ätliga varor.
Det ger rodnad i ögonen och huden, förutom att hosta och halssmärta. Det är en toxisk förening, även om den är lätt manipulerbar med bara händer om intaget undviks till varje pris.
Det är inte brandfarligt, men vid höga temperaturer bryts det ner och bildar Bao och CO2, Giftiga och oxiderande produkter som kan få andra material att brinna.
I organismen deponeras barium i ben och andra vävnader, vilket ersätter kalcium i många fysiologiska processer. Det blockerar också kanalerna där kjonerna reser+, förhindrar dess diffusion genom cellmembran.
Referenser
- Pub. (2018). Bariumkarbonat. Hämtad den 24 mars 2018 från PubChem: PubChem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2017). Bariumkarbonat. Hämtad den 24 mars 2018 från Wikipedia: i.Wikipedia.org
- Kemikaliebok. (2017). Bariumkarbonat. Hämtad den 24 mars 2018 från ChemicalBook: Chemicalbook.com
- Robbins Manuel a. (1983).Robbins The Collector's Book of Fluorescent Minerals. Fluorescerande mineraler Beskrivning, P-117.
- Shiver & Atkins. (2008). Oorganisk kemi. I Strukturen för enkla fasta ämnen (fjärde upplagan., p. 99-102). MC Graw Hill.