Kalciumkarbid (CAC2) struktur, egenskaper, erhållning, användning

- 2931
- 472
- Lars Eriksson
han Kalciumkarbid Det är en oorganisk förening som bildas av kalcium (CA) och kol (C) element (C). Dess kemiska formel är CAC2. Det är en fast som kan vara färglös till gulaktig eller gråaktig vit och till och med svart beroende på de föroreningar som den innehåller.
En av hans viktigaste kemiska reaktioner från CAC2 är den som inträffar med vatten h2Eller i vilken HC≡CH -acetylenform. Därför används det för att erhålla acetylen industriellt. På grund av samma vattenreaktion används reaktionen för att mogna frukter, i falska kanoner och i flottor flares.
 CAC kalciumkarbid2 fast. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons.
CAC kalciumkarbid2 fast. Ondřej Mangl / Pub Domain. Källa: Wikimedia Commons. CAC: s reaktion2 Med vatten producerar också en användbar lera för att förbereda klinker (en cementkomponent), som producerar mindre koldioxid (CO2) Om det jämförs med den traditionella metoden för att producera cement.
Med kväve (n2) Kalciumkarbidform Cyanamid av kalcium, som används som gödningsmedel. CAC2 Det används också för att ta bort svavel från vissa metalllegeringar.
För en tid sedan CAC2 Det användes i de så kallade karbidlamporna, men dessa är inte längre mycket vanliga eftersom de är farliga.
[TOC]
Strukturera
Kalciumkarbid är en jonisk förening och bildas av Ca -kalkiojonen2+ och karbid eller acetyluro c22-. Karbidjonen består av två kolatomer förenade med en trippelbindning.
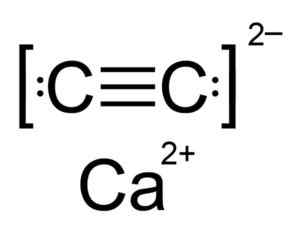 Kemisk struktur av kalciumkarbid. Författare: Hellbus. Källa: Wikimedia Commons.
Kemisk struktur av kalciumkarbid. Författare: Hellbus. Källa: Wikimedia Commons. CAC: s kristallina struktur2 Det härstammar från kubiken (såsom natriumklorid NaCl), men som Ion C22- Strukturen är långsträckt är förvrängd och blir tetragonal.
Nomenklatur
- Kalciumkarbid
- Kalciumkarbid
- Kalciumcetylyr
Egenskaper
Fysiskt tillstånd
Kristallint fast ämne att när rent är färglöst, men om det är förorenat med andra föreningar kan det vara gulaktigt eller grått till svart.
 CAC kalciumkarbid2 Med föroreningar. Leiem/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
CAC kalciumkarbid2 Med föroreningar. Leiem/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Molekylvikt
64,0992 g/mol
Det kan tjäna dig: Alilo: Allyic Unit, Carbocation, Radical, ExempelSmältpunkt
2160 ºC
Kokpunkt
CAC2 kokar vid 2300 ° C med nedbrytning. Kokpunkten bör mätas under inert atmosfär, det vill säga utan syre eller fukt.
Densitet
2,22 g/cm3
Kemiska egenskaper
Kalciumkarbid reagerar med vatten för att bilda HC≡CH -acetylen och Ca kalciumhydroxid (OH)2:
Cac2 + 2 h2O → HC≡CH + CA (OH)2
Acetylen är brandfarlig, därför i närvaro av fukt CAC2 Det kan vara brandfarligt. Men när det är torrt är det inte.
 CAC kalciumkarbid2 Med vatten HC≡CH -acetylenform, brandfarlig förening. Kristina Kravets/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
CAC kalciumkarbid2 Med vatten HC≡CH -acetylenform, brandfarlig förening. Kristina Kravets/CC BY-S (https: // Creativecommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. Kalciumkarbid reagerar med kväve n2 För att bilda CACN Calcio Cyanamide2:
Cac2 + N2 → Cacn2 + C
Erhållande
Kalciumkarbid produceras industriellt i en elektrisk bågsugn baserad på en blandning av kalciumkarbonat (Caco3) och kol (c) som lämnas in vid en temperatur av 2000 ° C. Reaktionen sammanfattas enligt följande:
Tjuv3 + 3 C → CAC2 + CO ↑ + Co2↑
Eller också:
CAO + 3 C → CAC2 + Co ↑
I en elektrisk bågugn finns det en elektricitetsbåge mellan två grafitelektroder, som motstår de höga temperaturerna som bildas. En kalciumkarbid med 80-85% renhet erhålls.
Ansökningar
I acetylenproduktion
Industriellt används kalciumkarbidreaktion med vatten för att producera acetylen C2H2.
Cac2 + 2 h2O → HC≡CH + CA (OH)2
Detta är den viktigaste användningen av kalciumkarbid. I vissa länder är acetylen mycket uppskattat, eftersom det gör det möjligt att producera polyvinylklorid, vilket är en typ av plast. Dessutom tjänar acetylen till att utföra svetsar vid höga temperaturer.
 HC≡CH acetylenflammetaller vid mycket höga temperaturer. Författare: Shutterbug75. Källa: Pixabay.
HC≡CH acetylenflammetaller vid mycket höga temperaturer. Författare: Shutterbug75. Källa: Pixabay. För att minska CO -utsläppen2
Resterna erhållna från att erhålla acetylen från CAC2 (även kallad "kalciumkarbidslam" eller "kalciumkarbidrester") De tjänar till att användas för att få klinker eller betong.
Kan tjäna dig: tekniska tillämpningar av elektroniska utsläpp av atomerKalciumkarbid lera har ett högt kalciumhydroxidinnehåll (CA (OH)2) (cirka 90%), en del kalciumkarbonat (Caco3) och har ett pH större än 12.
 Kalciumkarbidrester kan användas i konstruktionsaktiviteten för att förbereda betong, vilket minskar genereringen av CO2 av nämnda bransch. Författare: Engin Akyurt. Källa: Pixabay.
Kalciumkarbidrester kan användas i konstruktionsaktiviteten för att förbereda betong, vilket minskar genereringen av CO2 av nämnda bransch. Författare: Engin Akyurt. Källa: Pixabay. Av dessa skäl kan du reagera med SIO2 eller al2ANTINGEN3 bildar en produkt som liknar den som erhålls genom cementhydreringsprocessen.
En av de mänskliga aktiviteterna som producerar mest samutsläpp2 Det är byggbranschen. Kompaniet2 Det genereras öster om kalciumkarbonat under reaktionen för att bilda betong.
Använda kalciumkarbid lera för att ersätta kalciumkarbonat (Caco3) Det har visat sig att samutsläpp reduceras2 I 39%.
Vid erhållning av kalciumcyanamid
Kalciumkarbid används också industriellt för att erhålla kalciumcyanamid CACN2.
Cac2 + N2 → Cacn2 + C
Kalciumcyanamid har användning som gödningsmedel, eftersom det med markvatten blir cyanamid H2N = C = N, som ger kväve till växter, ett viktigt näringsämne för dessa.
I den metallurgiska industrin
Kalciumkarbid används för att ta bort legeringar som Ferroníquel. CAC är blandad2 Med den smälta legeringen vid 1550 ° C. Svavel (er) reagerar med kalciumkarbid och kalciumsulfid CAS och kol C:
Cac2 + S → 2 C + CAS
Svavelborttagning gynnas om blandningen är effektivt och kolhalten i legering är låg. Casclium kalciumsulfid flyter på ytan av den smälta legeringen där den väljer och kasseras.
I flera användningsområden
Kalciumkarbid har använts vid eliminering av järnsvavel. Också som bränsle i produktionen av stål och som en kraftfull deoxidant.
Kan tjäna dig: aromatisk elektrofil substitution: mekanism och exempelDet används för att mogna frukt. Från kalciumkarbid med vatten genereras acetylen, vilket inducerar mognad av frukt, såsom bananer.
 Bananer kan mogna med CAC -kalciumkarbid2. Författare: Alexas Photos. Källa: Pixabay.
Bananer kan mogna med CAC -kalciumkarbid2. Författare: Alexas Photos. Källa: Pixabay. Kalciumkarbid används i falska kanoner för att orsaka det höga explosionsbruset som kännetecknar dem. Här används också acetylenbildning, som exploderar med en gnista inom artefakten.
CAC2 Det används för att generera signaler på de höga haven i flottor som själv överväger att överväga.
Avbruten användning
CAC2 Det har använts i de så kallade karbidlamporna. Driften av dessa består av att droppa vatten på kalciumkarbid för att bilda acetylen, som tänds och därmed ger ljus.
Dessa lampor användes i kolgruvor, men deras användning avbröts på grund av närvaron av metangascho4 I dessa gruvor. Denna gas är brandfarlig och karbidlampans låga kan få den att skjuta eller utnyttja.
 CAC kalciumkarbidlampa2. Scehardt / pubdomän. Källa: Wikimedia Commons.
CAC kalciumkarbidlampa2. Scehardt / pubdomän. Källa: Wikimedia Commons. De användes allmänt i skifferberggruvor, koppar och tenn, och även i de första bilarna, motorcyklar och cyklar, som framljus eller strålkastare.
De har för närvarande ersatts av elektriska lampor eller till och med LED -lampor. Men de används fortfarande i länder som Bolivia, i Potosí Silver Mines.
Risker
CAC kalciumkarbid2 torrt är inte brandfarligt men i närvaro av fuktform acetylen, vilket är.
För att släcka en brand i närvaro av CAC2 Vatten, skum, koldioxid eller halogensläckare bör aldrig användas. Natrium- eller kalciumhydroxid bör användas.
Referenser
- Ropp, r.C. (2013). Grupp 14 (C, SI, GE, SN och PB) alkaliska jordföreningar. Kalciumkarbider. I encyklopedi av de alkaliska jordföreningarna. Återhämtat sig från Scientedirect.com.
- Pohanish, r. P. (2017). C. Karbidkalcium. I Sittigs handbok av giftiga och farliga kemikalier och cancercinagener (sjunde upplagan). Återhämtat sig från Scientedirect.com.
- Sol, h. et al. (2015). Egenskaper hos kemiskt förbryllad kalciumkarbid reser och dess inffektiv på cementegenskaper. Material 2015, 8, 638-651. NCBI återhämtade sig.Nlm.Nih.Gov.
- Nie, Z. (2016). Ekomaterial och livscykelbedömning. Fallstudie: CO2 Utsläppsanalys av kalciumkarbidslam Clinker. I grön och hållbar tillverkning av avancerat material. Återhämtat sig från Scientedirect.com.
- Crundwell, f.K. Et al. (2011). Raffineringsmönst. Avlägsnande av svavel. I utvinning av metallurgi av nickel-, kobolt- och platina -gruppmetaller. Återhämtat sig från Scientedirect.com.
- TRESSLER, R.OCH. (2001). Strukturell och termmostrukturell keramik. Karbider. I encyklopedi av materialvetenskap och teknik. Återhämtat sig från Scientedirect.com.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.

