Elektrokemiska celler

- 4788
- 236
- Per Eriksson
Vad är elektrokemiska celler?
De elektrokemiska celler Det är enheter där kemiska reaktioner passerar där kemisk energi omvandlas till el eller vice versa. Dessa celler utgör hjärtat av elektrokemi, själen är det potentiella utbytet av elektroner som kan uppstå, spontan eller inte spontant, mellan två kemiska arter.
En av de två arterna oxiderar, förlorar elektroner, medan den andra reduceras genom att vinna de cedade elektronerna. Vanligtvis är arten som reduceras en metallisk katjon i lösning, som genom att få elektriskt hamnar elektriskt på en elektrod gjord av samma metall. Å andra sidan är de arter som oxiderar en metall och blir metallkationer.
 Daniels elektrokemiska celldiagram. Källa: Rechua [CC av (https: // CreativeCommons.Org/licenser/av/3.0)]
Daniels elektrokemiska celldiagram. Källa: Rechua [CC av (https: // CreativeCommons.Org/licenser/av/3.0)] Till exempel representerar den överlägsna bilden Daniels cell: den enklaste av alla elektrokemiska celler. Den metalliska zinkelektroden oxideras och släpper Zn -katjoner2+ till den vattenhaltiga miljön. Detta inträffar i ZnSO -behållaren4 från vänster.
Till höger, lösningen som innehåller CUO4 Det reduceras, omvandlar katjoner CU2+ I metallisk koppar som avsätts på kopparelektroden. Under utvecklingen av denna reaktion reser elektroner en extern krets som aktiverar sina mekanismer; Och därför tillhandahålla el för drift av en utrustning.
Elektrokemiska cellkomponenter
Elektroder
I elektrokemiska celler genereras eller konsumeras. För att säkerställa ett korrekt flöde av elektroner måste det finnas material som är bra elektricitetsledare. Det är här elektroder och extern krets kommer, försedd med kopparledningar, silver eller guld.
Elektroderna är materialen som ger ytan där reaktioner i elektrokemiska celler kommer att utvecklas. Det finns två typer enligt reaktionen som inträffar i dem:
- Anod, elektrod där oxidation inträffar.
- Katod, elektrod där reduktionen inträffar.
Elektroderna kan vara gjorda av ett reagerande material, som i fallet med Daniels cell (zink och koppar); eller av ett inert material, som är fallet när de är gjorda av platina eller grafit.
Elektroner som tilldelats av anoden måste nå katoden; Men inte genom en lösning, utan reser en metallkabel som förenar båda elektroderna till en extern krets.
Elektrolytupplösning
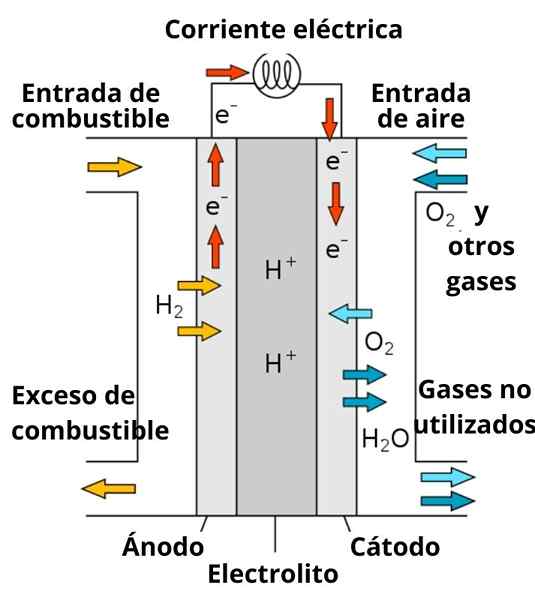 Schema för ett protoner ledande bränslebatteri
Schema för ett protoner ledande bränslebatteri Upplösningen som omger elektroderna spelar också en viktig roll, eftersom den är berikad med starka elektrolyter; som: kcl, kno3, NaCl, etc. Dessa joner gynnar till viss del migrationen av elektroner från anoden till katoden, liksom deras ledning i närheten av elektroderna för att interagera med arten för att minska.
Havsvatten leder till exempel mycket bättre el än destillerat vatten, med lägre jonkoncentration. Det är därför elektrokemiska celler har en lösning av starka elektrolyter bland sina komponenter.
Saltlösning
Lösningens joner börjar omge elektroderna som orsakar en polarisering av belastningarna. Upplösningen runt katoden börjar laddas negativt, eftersom katjoner minskas; När det gäller Daniels cell, Cu -katjoner2+ Genom att deponera som en metallisk koppar på katoden. Således finns det ett underskott på positiva avgifter.
Det är här saltbryggan ingriper för att balansera belastningarna och förhindra att elektroderna är polariserade. Till sidan eller facket av katodkatjonerna i saltbron kommer att migrera, antingen K+ eller Zn2+, Att ersätta CU2+ förbrukad. Under tiden kommer inte saltbron att migrera anjoner3- Mot anodfacket, för att neutralisera den växande koncentrationen av Zn -katjoner2+.
Det kan tjäna dig: kaliumdikromat: formel, egenskaper, risker och användningarSaltbryggan består av en mättad salterlösning, med ändarna täckta av en permeabel jongel, men vattentät för vatten.
Typer av elektrokemiska celler och hur de fungerar
Det sätt på vilket en elektrokemisk cell fungerar beror på den typ som är. Det finns i grunden två typer: galvanisk (eller voltaisk) och elektrolytisk
Galvanik
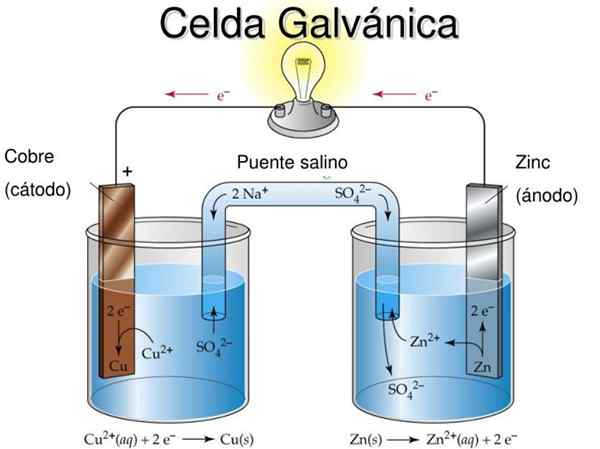
Daniels cell är ett exempel på en galvanisk elektrokemicell. I dem inträffar reaktionerna spontant och batteriets potential är positiv; Ju större potential, desto större är elen som kommer att leverera cellen.
Batterierna eller batterierna är exakt galvaniska celler: den kemiska potentialen mellan de två elektroderna förvandlas till elektrisk energi när en extern krets ingriper som förbinder dem. Således migrerar elektroner från anoden, tänd utrustningen som batteriet är anslutet till och återförs direkt till katoden.
Elektrolytisk
Elektrolytiska celler är de vars reaktioner inte inträffar spontant, såvida de inte levereras av elektrisk energi från en extern källa. Här inträffar det motsatta fenomenet: elektricitet tillåter icke -spontana kemiska reaktioner att utvecklas.
En av de mest kända och värdefulla reaktionerna som äger rum inom denna typ av cell är elektrolys.
Uppladdningsbara batterier är exempel på elektrolytiska och samtidigt galvaniska: de laddas upp för att vända sina kemiska reaktioner och återupprätta de initiala förhållandena för att återanvända igen.
Exempel
Daniels cell
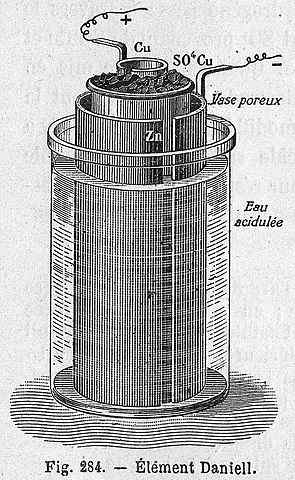 Daniels cellschema
Daniels cellschema Följande kemisk ekvation motsvarar reaktionen från Daniels cell där zink och koppar deltar:
Kan tjäna dig: hyra halogenuros: fastigheter, erhålla, exempelZn (s) + cu2+(aq) → Zn2+(aq) + cu (s)
Men Cu -katjoner2+ och zn2+ De är inte ensamma utan åtföljs av SO -anjonerna42-. Denna cell kan representeras enligt följande:
Zn | Znso4 | | Cuso4 | Cu
Daniels cell kan byggas i alla laboratorier, som är mycket återkommande som en praxis i introduktionen av elektrokemi. Som cu2+ Det deponeras som Cu, den blå färgen på CUSO -lösningen4 Det kommer att gå förlorat.
Platina och vätecell
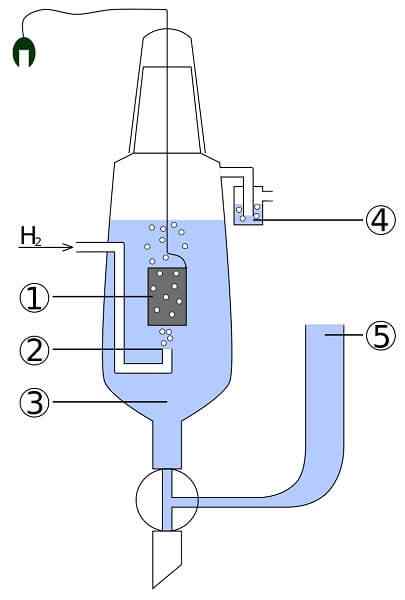 Schema för en platin- och vätecell: 1. 2 Platinelektrod. Vätegas 3. Syralösning 4. Hidroseal 5. Fackförening
Schema för en platin- och vätecell: 1. 2 Platinelektrod. Vätegas 3. Syralösning 4. Hidroseal 5. Fackförening Föreställ dig en cell som konsumerar gasformigt väte, producerar metallsilver och samtidigt tar det elektricitet. Detta är platin- och vätecellen, och dess allmänna reaktion är följande:
2agcl (s) + h2(g) → 2AG (S) + 2H+ + 2cl-
Här i anodfacket har vi en inert platinelektrod, nedsänkt i vatten och till vilken gasväte pumpas. H2 bli oxiderad till h+ och ger sina elektroner till AGCL: s mjölkiga fällning i katodfacket med en metallsilverelektrod. AGCL kommer att reduceras på detta silver och elektroddegen kommer att öka.
Denna cell kan representeras som:
Pt, h2 | H+ | | Kli-, Agcl | Ag
Nedgångscell
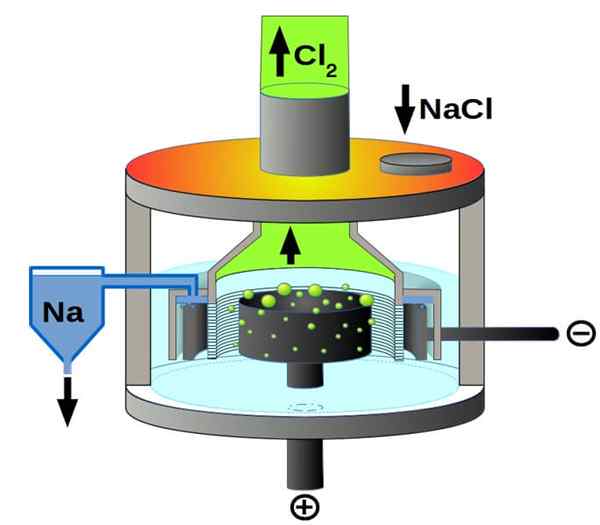 Downs Cell Scheme för natriumkloridelektrolys. Källa: Pchemiker, CC BY-SA 4.0, via Wikimedia Commons
Downs Cell Scheme för natriumkloridelektrolys. Källa: Pchemiker, CC BY-SA 4.0, via Wikimedia Commons Och slutligen, bland de elektrolytiska cellerna har vi den smälta natriumkloriden, bättre känd som Downs Cell. Här är el att resa genom elektroderna en volym smält NaCl och härstammar således i dem följande reaktioner:
2: a+(l) + 2e- → 2NA (s) (katod)
2cl-(L) → Cl2(g) + 2e- (anod)
2NACL (L) → 2NA (S) + Cl2(g) (global reaktion)
Tack vare elektricitet och natriumklorid kan således metalliskt natrium och klorgas framställas.

