Kaliumcyanid (KCN) egenskaper, användningar, strukturer, risker,

- 4012
- 190
- Anders Larsson
han Kaliumcyanid Det är en oorganisk förening som bildas av en jonkalium k+ och en CN -cyanidjon-. Dess kemiska formel är KCN. Det är ett kristallint vitt fast, extremt giftigt.
KCN är mycket löslig i vatten och vid lösning är det hydrolyserat och bildar cyanhydronsyra eller HCN -vätecyanid, vilket också är mycket giftigt. Kaliumcyanid kan bilda sammansatta salter med guld och silver så det användes för att extrahera dessa ädelmetaller från vissa mineraler.
 Fast KCN kaliumcyanid. Morienus (Uppladdad av DE: Benutzer: Bxxxd från: Wiki) [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons.
Fast KCN kaliumcyanid. Morienus (Uppladdad av DE: Benutzer: Bxxxd från: Wiki) [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikimedia Commons. KCN används för att täcka billiga metaller med guld och silver genom en elektrokemisk process, det vill säga en metod där en elektrisk ström passeras genom en lösning som innehåller ett salt som består av ädelmetall, cyanid och kalium.
Kaliumcyanid eftersom den innehåller cyanid måste manipuleras med stor försiktighet, med adekvata redskap. Det bör aldrig kasseras för miljön, eftersom det också är mycket giftigt för de flesta djur och växter.
Metoder som använder vanliga alger studeras emellertid för att avlägsna förorenad vattenkaliumcyanid med låga koncentrationer av detta.
[TOC]
Strukturera
KCN är en jonisk förening bildad av en kaliumkatjon K+ och en cyanidanjon CN-. I detta är kolatomen kopplat till kväveatomen genom en trippel kovalent bindning.
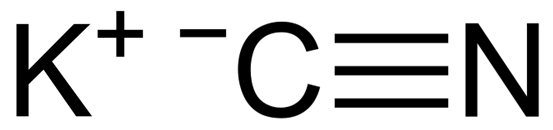 KCN kaliumcyanidkemisk struktur. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
KCN kaliumcyanidkemisk struktur. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. I fast kaliumcyanid CN -anjonen- Det kan rotera fritt genom vad som uppför sig som en sfärisk anjon, som en följd av att KCN -kristallen har en kubisk struktur som liknar den hos KCL -kaliumkloriden.
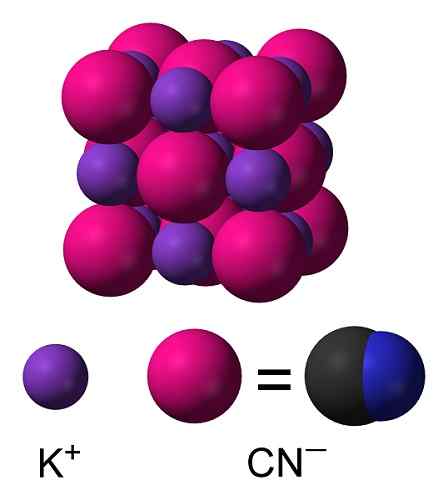 KCN -kristallstruktur. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons.
KCN -kristallstruktur. Benjah-Bmm27 [Public Domain]. Källa: Wikimedia Commons. Nomenklatur
- Kaliumcyanid
- Kaliumcyanid
- Cianopotasio
Egenskaper
Fysiskt tillstånd
Vit kristallint fast. Kubikkristaller.
Molekylvikt
65,116 g/mol.
Smältpunkt
634,5 ° C
Det kan tjäna dig: aluminiumsulfat (AL2 (SO4) 3)Kokpunkt
1625 ° C.
Densitet
1,55 g/cm3 vid 20 ° C.
Löslighet
Mycket lösligt i vatten: 716 g/L vid 25 ° C och 100 g/100 ml vatten vid 80 ° C. Lite lösligt i metanol: 4,91 g/100 g metanol vid 19,5 ° C. Mycket lite lösligt i etanol: 0,57 g/100 g etanol vid 19,5 ° C.
pH
En vattenlösning av 6,5 g kcn i 1 l vatten har ett pH på 11,0.
Hydrolyskonstant
KCN är mycket löslig i vatten. När cyanidjon CN är gratis- som tar en proton h+ vatten för att bilda HCN cyanhydronsyra och frigöra en OH -jon-:
Cn- + H2O → HCN + OH-
Hydrolyskonstanten indikerar trenden med vilken nämnda reaktion utförs.
Kh = 2,54 x 10-5
KCN -vattenhaltiga lösningar släpper HCN -vätecyanidmiljön när de värmer upp 80 ° C.
Kemiska egenskaper
Det är inte brandfarligt, men när den fasta KCN upphettas tills dess sönderdelning avger mycket giftigt HCN -vätescyanid, gör kväveoxider intex, K -kaliumoxid2O och kolmonoxid.
KCN reagerar med guldsalter som bildar kalium Aurocianuro Kau (CN)2 och kalium Auricianuro Kau (CN)4. Dessa är komplex färglösa salter. Med Silver Metal AG bildar KCN kalium Argentocyanid KAG (CN)2.
KCN -cyanidjonen reagerar med vissa organiska föreningar som har halogen (såsom klor eller brom) och upptar platsen för dessa. Till exempel reagerar den med bromättiksyra för att ge cyanättiksyra.
Andra egenskaper
Det är hygroskopiskt, absorberar miljöens fukt.
Den har en mjuk lukt av bittera mandlar, men detta upptäcks inte av alla människor.
Erhållande
KCN framställs av KOH -kaliumhydroxidreaktionen i vattenlösning med HCN -vätescyanid. Kaliumferrocyanid K erhålls också genom uppvärmning4Tro (CN)6:
K4Tro (CN)6 → 4 kcn + 2 c + n2↑ + tro
Användning i metallelektrod
Det används i processen att täcka små värdefulla metaller med guld och silver. Det är en elektrolytisk process, det vill säga elektricitet passeras genom en vattenlösning med lämpliga salter.
Det kan tjäna dig: svaveltrioxid (SO3): Struktur, egenskaper, risker, användningarSilver
Kalium Argentocyanid Kag (CN) används2 Till beläggning med billigare metaller (AG).
Dessa placeras i en vattenlösning av kaliumkag (CN)2, Där den positiva anoden eller polen är en ren silverstång (Ag) och katoden eller negativ pol är den billiga metallen som är ville täcka silver.
När en elektrisk ström passerar genom lösningen deponeras silver på den andra metallen. När cyanidsalter används deponeras silverskiktet på ett finare, mer kompakt och vidhäftande sätt än i lösningar av andra föreningar.
 Vissa smycken är täckta med silver med KCN -salter. Författare: Stocksnap. Källa: Pixabay.
Vissa smycken är täckta med silver med KCN -salter. Författare: Stocksnap. Källa: Pixabay. Guld
På samma sätt när det gäller guld (AU), kalium aurocyanid KAU (CN)2 och kalium Auricianuro Kau (CN)4 Andra metaller används för att elektrolytiskt bruna.
 Elektriska anslutningar belagda med guld eventuellt med KCN -salter. CJP24 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Elektriska anslutningar belagda med guld eventuellt med KCN -salter. CJP24 [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Andra användningsområden
Några andra användningar av kaliumcyanid nämns nedan.
- För den industriella processen för härdande nitrationsstål (kväve tillsats).
- För metallrengöring.
- I utskrifts- och fotograferingsprocesser.
- Tidigare användes det för extraktion av guld och silver från mineralerna som innehåller dem, men sedan ersattes det av natrium -NACN -cyaniden som är billigare, även om det är lika giftigt.
- Som insektsmedel för rökning av träd, fartyg, järnvägsbilar och lager.
- Som ett reagens i analytisk kemi, det vill säga att göra kemisk analys.
- För att framställa andra kemiska föreningar, såsom färgämnen och färgämnen.
 Guldekstraktion i Sydafrika 1903 med KCN vad som var i dödlig förorening av den omgivande miljön. Argyll, John Douglas Sutherland Campbell, Duke of, 1845-1914; Creswicke, Louis [inga begränsningar]. Källa: Wikimedia Commons.
Guldekstraktion i Sydafrika 1903 med KCN vad som var i dödlig förorening av den omgivande miljön. Argyll, John Douglas Sutherland Campbell, Duke of, 1845-1914; Creswicke, Louis [inga begränsningar]. Källa: Wikimedia Commons. Risker
KCN är en mycket giftig förening för djur och de flesta växter och mikroorganismer. Klassificeras som super giftig. Det är fortfarande dödligt i mycket små mängder.
Det kan tjäna dig: nickelklorid (NICL2): Struktur, egenskaper, erhållning, användningDess skadliga effekt kan uppstå genom inandning, kontakt med huden eller ögonen eller intag. Hämmar många metaboliska processer, särskilt blodproteiner som deltar i syretransport såsom hemoglobin.
Det påverkar organen eller systemen mer känsliga för bristen på syre, såsom centrala nervsystemet (hjärnan), det hjärt -kärlsystemet (hjärt- och blodkärl) och lungor.
 Kaliumcyanid är ett gift. Författare: Clker-fri-vektorbilder. Källa: Pixabay.
Kaliumcyanid är ett gift. Författare: Clker-fri-vektorbilder. Källa: Pixabay. Handlingsmekanism
KCN stör kroppens förmåga att använda syre.
Cyanidjon CN- av KCN har en stor affinitet för Feric Tro Faith3+, Vilket innebär att när cyanid absorberar det reagerar snabbt med tro3+ Blod och vävnader.
På detta sätt förhindrar det andningen av celler, som kommer in i ett tillstånd av brist på syre, för även om de försöker andas kan de inte använda det.
Det inträffar sedan ett övergående tillstånd av hipperapnea (andningsupphängning) och huvudvärk och slutligen död genom andningsstopp.
Ytterligare risker
Vid uppvärmning producerar den mycket giftiga gaser som HCN, kväveoxiderx, K -kaliumoxid2O och kolmonoxid.
Vid kontakt med HCN -fukt som är mycket brandfarlig och mycket giftig.
KCN är också mycket giftigt för vattenlevande organismer. Det bör aldrig kasseras i miljön, eftersom vattenföroreningar kan uppstå där de dricker djur och bor i fisk.
Det finns emellertid bakterier som producerar cyanid som Chromobacterium violaceum och några arter av Pseudomonas.
Nyliga studier
Vissa forskare fann att de gröna algerna Chlorella vulgaris Det kan användas för att behandla förorenat vatten med KCN -kaliumcyanid i låga koncentrationer.
Alger kunde effektivt ta bort KCN, eftersom detta i låga mängder stimulerade algerens tillväxt eftersom den aktiverade en intern mekanism för att motstå toxiciteten för KCN.
Detta betyder att algerna Chlorella vulgaris Det har potential att ta bort cyanid och att en effektiv metod för biologisk behandling av cyanidföroreningar kan utformas med detta.
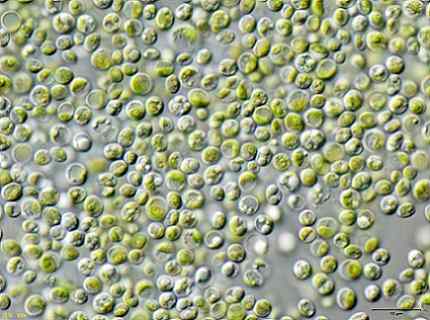 Algerbild Chlorella vulgaris observerad i ett mikroskop. JA: Användare: neon / användare: neon_ja [cc by-sa 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons.
Algerbild Chlorella vulgaris observerad i ett mikroskop. JA: Användare: neon / användare: neon_ja [cc by-sa 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikimedia Commons. Referenser
- ELLER.S. National Library of Medicine. (2019). Kaliumcyanid. Nationellt centrum för bioteknikinformation. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Coppock, r.W. (2009). Hot mot djurliv av kemiska krigsföringsmedel. I Handbook of Toxicology of Chemical Warfare Agents. Återhämtat sig från Scientedirect.com.
- Liu, q. (2017). Utvärdering av avlägsnande av kaliumcyanid och dess toxicitet i gröna alger (Chlorella vulgaris). Tjurmiljö kontam toxicol. 2018; 100 (2): 228-233. NCBI återhämtade sig.Nlm.Nih.Gov.
- National Institute for Occupational Safety and Health (NIOSH). (2011). Kaliumcyanid: systemiskt medel. CDC återhämtat sig.Gov.
- Alvarado, l.J. et al. (2014). Riboswitch upptäckt, struktur och funktion. Syntes av uracil. I metoder i enzymologi. Återhämtat sig från Scientedirect.com.
- « Natriumtripolifosfat (Na5P3O10) struktur, egenskaper, användningar, påverkan
- Eftersom jag är väldigt sömnig? 9 orsaker och lösningar »

