Cykelegenskaper, reaktioner, användningar, exempel
- 2338
- 696
- Karl Johansson
De Cykloalkaner De är en familj av mättade kolväten med en allmän formel på CnH2n som sammanfaller med Alkenes; med skillnaden att den uppenbara omättningen inte beror på en dubbelbindning, utan på en ring eller cykel. Det är därför de betraktas som Alquenos -isomerer.
Dessa bildas när linjära alkaner förenar ändarna på deras kedjor för att komma från en stängd struktur. Liksom med alkanerna kan cykloalcan uppvisa olika storlekar, molekylmassor, substitutioner eller till och med system som består av mer än en ring (polycykliska).
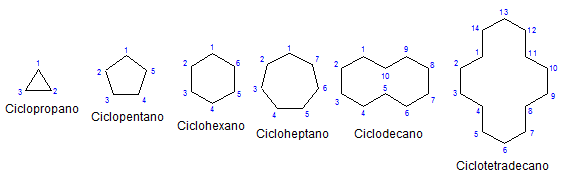
 Några monocykliska cykloalcanos. Källa: Mephisto Spa via Wikipedia.
Några monocykliska cykloalcanos. Källa: Mephisto Spa via Wikipedia. Av resten, kemi och fysiskt liknar de alkanerna. De har bara kol och kolhydare, de är neutrala molekyler och interagerar därför genom van der väggar krafter. De fungerar också som bränslen och släpper värme när de bränner i närvaro av syre.
Varför är Cycloalcanos mer instabila än deras öppna kedja motsvarigheter? Anledningen kan misstänkas genom att observera exemplen på cykloalkaner representerade i den övre bilden: det finns steriska (rumsliga) spänningar och hinder.
Observera att ju mindre kol (listade i blått), desto mer stängd är strukturen; Och det motsatta händer när de ökar och vänder sig som ett halsband.
Små cykloalkaner är gasformiga, och när deras storlekar ökar sina intermolekylära krafter. Följaktligen kan de vara flytande som kan lösa fett och apolärt, smörjmedel eller fasta ämnen som ser mörka färger och egenskaper som asfaltfärger.
[TOC]
Fysiska och kemiska egenskaper
Polaritet
När de bara komponeras av kol och väten, atomer som inte skiljer sig för mycket i elektronegativitet, gör detta cykloalc -molekylerna apolära och saknar därför ett dipolmoment.
De kan inte interagera genom dipol-dipolkrafter, men de beror specifikt på Londons styrkor, som är svaga men som ökar med molekylmassa. Det är därför små cykloalkaner (med mindre än fem kol) är gasformiga.
Intermolekylär interaktioner
Å andra sidan, eftersom de är ringar, har cykloalkaner ett större kontaktområde, som gynnar Londons styrkor bland sina molekyler. Således grupperas de och interagerar bättre jämfört med alkaner; Och därmed är dess kokande och fusionspunkter högre.
Eftersom de har två mindre väteatomer (cnH2n För cykloalcanos och cnH2n+2 För alkaner) är de lättare; Och tillägg till detta faktum av dess största kontaktområde, minskar den volym som dess molekyler ockuperar, och därför är de tätare.
Mättnad
Varför klassificeras cykloalkaner som mättade kolväten? Eftersom de har hur de integrerar en vätemolekyl; Såvida inte ringen öppnas, och i så fall skulle de bli enkla alkaner. För att ett kolväte ska betraktas som mättat måste det ha det maximala antalet C-H-länkar.
Det kan tjäna dig: potentiometer (phameter)Stabilitet
Kemiskt liknar de mycket alkaner. Båda har C-C- och C-H-länkar, som inte är så lätta att bryta för att orsaka andra produkter. Emellertid skiljer sig deras relativa stabilitet, vilket kan verifieras experimentellt genom att mäta deras förbränningsvärme (ΔHhårkam).
Till exempel, jämfört med ΔHhårkam För propan och cyklopropo (representerad av en triangel i bilden) finns det 527,4 kcal/mol respektive 498,9 kcal/mol.
Detaljen är att cyklopropanenhårkam Mindre (471 kcal/mol) eftersom de är tre metylengrupper, Cho2; Men i verkligheten släpper det mer värme, vilket återspeglar instabilitet större än det uppskattade. Denna överflödiga energi sägs att det beror på spänningar inuti ringen.
Och i själva verket styr och differentierar dessa spänningar reaktiviteten eller stabiliteten hos cykloalcanos, med avseende på alkanerna, mot specifika reaktioner. Så länge spänningarna inte är så höga tenderar cykloalcanerna att vara mer stabila än deras respektive toppar.
Nomenklatur
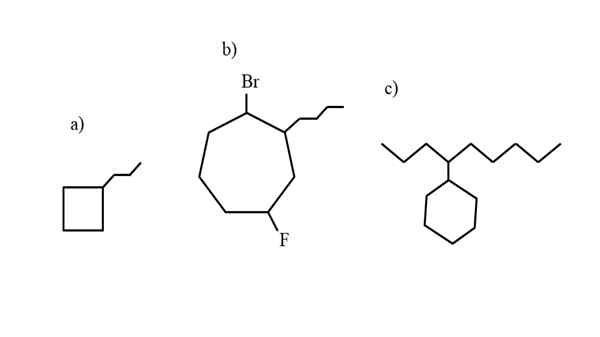 Några exempel på substituerad cykloalcan för att testa nomenklaturreglerna. Källa: Gabriel Bolívar.
Några exempel på substituerad cykloalcan för att testa nomenklaturreglerna. Källa: Gabriel Bolívar. Nomenklaturen som styrs av IUPAC för cykloalcanos skiljer sig inte för mycket än Alkanes. Den enklaste regeln av alla är att placera cykelprefixet- till namnet på alkanen som cykloalcanen är bildad.
Således, till exempel av n-hexan, cho3Ch2Ch2Ch2Ch2Ch3, Cyclohexan erhålls (representerad av en hexagon i den första bilden). På samma sätt som det händer med cyklopropan, cyklobutan, etc.
Nu kan dessa föreningar drabbas av substitutioner från en av deras hydrogener. När antalet kolkolor är högre än för hyresubstituenterna, tas ringen som huvudkedjan; Detta är fallet med a) för den överlägsna bilden.
Observera att i a) cyklobutanen (torget) har fler kol än propilusgruppen kopplad till den; Då kallas denna förening som propylciclobutano.
Om det finns mer än en substituent, bör de namnges i alfabetisk ordning och på ett sådant sätt att de har minst möjliga lokaliseringsnummer. Till exempel kallas b): 1-bromo-4-fluoro-2-butilcicloheptano (och inte 1-bromo-5-fluoro-7-butylcicloheptano, som skulle vara felaktigt).
Och slutligen, när den alquiliska substituenten har fler kol än ringen, sägs det då att den senare är ersättningsgruppen för huvudkedjan. Således kallas c): 4-cyklohexilnonano.
Kan tjäna dig: metalloxiderStrukturera
När de lämnar de substituerade cykanerna är det bekvämt att bara fokusera på deras strukturella baser: ringarna. Dessa representerades i den första bilden.
Vid observation av dem kan den falska idén uppstå att sådana molekyler är platta; Men med undantag för cyklopropo är dess ytor "sickzagenanter", med kolhydrater som går ner eller laddas upp i förhållande till samma plan.
Detta beror på att för att starta alla kolhydrater har SP -hybridisering3, och därför presentera tetraedriska geometrier med 109,5º länkvinklar. Men om ringens geometri noggrant observeras är det omöjligt för deras vinklar; Till exempel är vinklarna i cyklopropantriangeln 60º.
Detta är vad som kallas vinkelspänning. Ju större ringar, vinkeln mellan C-C-länkarna är närmare 109,5º, vilket orsakar en minskning av en sådan spänning och en ökning av stabiliteten för cykloalcan.
Ett annat exempel observeras i cyklobutanen, vars länkvinklar är 90º. Redan i cyklopentano är dess vinklar 108º, och från cyklohexan sägs det då att vinkelspänningen upphör att utöva en sådan anmärkningseffekt så kommenterade.
Konformationer
Förutom vinkelspänning finns det andra faktorer som bidrar till spänningen som upplevs av cykloalcanos.
C-C-länkar kan inte rotera utan mer, eftersom detta skulle innebära att hela strukturen "rys". Således kan dessa molekyler anta mycket väl definierade rumsliga konformationer. Syftet med dessa rörelser är att minska de spänningar som orsakas i förmörkelsen av väteatomer; det vill säga när en framför den andra.
Till exempel liknar konformationer för cyklobutanen en fjäril som slår sina vingar; de från Cyclopentano, ett kuvert; Cyclohexans, en båt eller stol, och ju större ringen är, desto större är antal och former de kan anta i rymden.
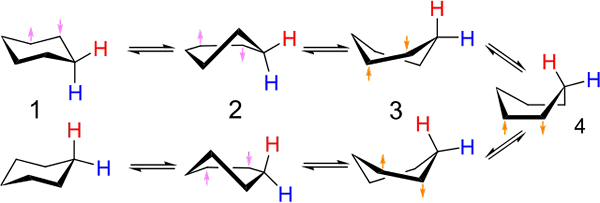 Investeringar mellan stol och båttypkonformation för cyklohexan. Källa: Kministi [CC0].
Investeringar mellan stol och båttypkonformation för cyklohexan. Källa: Kministi [CC0]. Den överlägsna bilden visar ett exempel på sådana konformationer för cyklohexan. Observera att den påstådda platta hexagon verkligen verkar mer som en stol (till vänster om bilden) eller en båt (höger). Ett väte representeras med röda texter och en annan med blå texter för att indikera hur deras relativa positioner förändras efter investeringar.
I (1), när väte är vinkelrätt mot ringplanet, sägs det att det är i axiellt läge; Och när det är parallellt med detta sägs det att det är i ekvatorial position.
Reaktioner
Reaktionerna som cykloalcan kan drabbas är desamma som för alkaner. Båda förbränner i närvaro av ett överskott av syre i de typiska förbränningsreaktionerna för att producera koldioxid och vatten. På samma sätt kan båda drabbas av halogeneringar, där ett väte ersätts av en halogenatom (F, Cl, BR, I).
Det kan tjäna dig: Fördelar och nackdelar med hälsokemi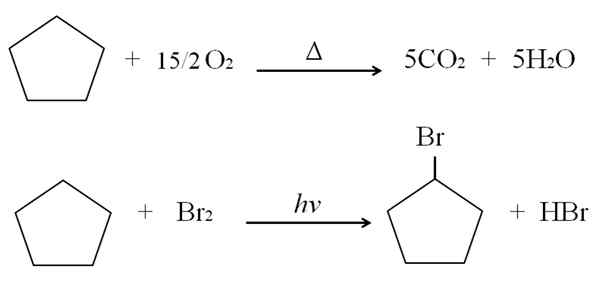 Cyklopentano -reaktioner. Källa: Gabriel Bolívar.
Cyklopentano -reaktioner. Källa: Gabriel Bolívar. Ovanför förbrännings- och halogeneringsreaktionerna för cyklopentano visas som ett exempel. En mullvad bränner i närvaro av värme och 7,5 mol molekylärt syre för att bryta ner i CO2 och h2ANTINGEN. Å andra sidan, i närvaro av ultraviolett och brom.
Ansökningar
Användningen av cykloalkaner beror till stor del på deras antal kol. Den lättaste och därför gasformiga, som en gång tjänade till att mata gaslamporna i offentliga ljus.
Vätskor har under tiden vinster som lösningsmedel för oljor, fetter eller kommersiella produkter av en apolär natur. Bland dessa kan du nämna cyklopentano, cyklohexan och cykloheptan. Likaså används de ofta i rutinmässiga operationer i Petróleos -laboratorier eller i bränsleformulering.
Om de är tyngre kan de användas som smörjmedel. Å andra sidan kan de också representera utgångsmaterialet för läkemedelssyntes; Som karboplatin, som i sin struktur inkluderar en cyklobutanring.
Cychannelexempel
Slutligen återgår den till början av artikeln: Bilden med flera icke -repeterade cykloalcanos.
För att memorera cykloalkanerna räcker det att tänka på de geometriska figurerna: triangel (cyklopropan), fyrkant (cyklobutan), Pentagon (Cyclopentano), hexagon.
Ju större ringen, desto mindre liknar den sin respektive geometriska figur. Det har redan sett att cyklohexan är allt annat än en hexagon; Detsamma händer mer uppenbarligen med cyklootetradecano (fjorton kol).
En punkt kommer där de kommer att bete sig som halsband som kan vikas för att minska spänningarna på deras länkar och förmörkelser till fullo.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. Aminer. (10: e upplagan.). Wiley Plus.
- Kemi librettexts. (2 juni 2019). Namnge cykloalkaner. Återhämtad från: kem.Librettexts.org
- Wikipedia. (2019). Cykloalkan. Hämtad från: i.Wikipedia.org
- Clark Jim. (2015). Introducerar alka och cykloalkaner. Återhämtat sig från: Chemguide.co.Storbritannien
- James Ashenhurst. (2019). Konformationer och cykloalkaner. Master Organic Chemistry. Återhämtat från: Masterorganicchemistry.com
- Fernández Germán. (s.F.). Cykloalcanos-tori. Organisk kemi. Återställt från: Chemicicicicaorganica.org

