Cyklohexenstruktur, egenskaper, syntes och användningar

- 964
- 119
- Johan Gustafsson
han Cyklohexen Det är en alken eller cyklisk olefin vars molekylformel är c6H10. Den består av en färglös vätska, olöslig i vatten och blandbar med många organiska lösningsmedel. Det kännetecknas av att vara brandfarligt, och i naturen finns det vanligtvis i Hulla Tar.
Cyklohexen syntetiseras genom partiell hydrering av bensen och genom uttorkning av cyklohexanolalkohol; det vill säga ett mer oxiderat sätt. Liksom andra cykloalquener upplever det elektrofilt tillägg och fria radikaler; Till exempel halogeneringsreaktion.
 Cyklohexenmolekyl. Källa: Neurotoger.
Cyklohexenmolekyl. Källa: Neurotoger. Denna cykliska (övre bild) bildar aceotropa blandningar (inte separerbara genom destillation), med lägre alkoholer och ättiksyra. Det är inte särskilt stabilt i långvarig förvaring, eftersom det sönderdelas under solljus och ultraviolett strålning.
Cyclohexen används som lösningsmedel, och därför har det många tillämpningar, såsom: bensinstabiliser för hög oktan.
Men det viktigaste är att cyklohexen fungerar som en mellanhand och råmaterial för att erhålla många föreningar av stor användbarhet, inklusive: cyklohexanon, adipinsyra, maleinsyra, cyklohexan, butyne, cyklohexylkarboxylsyra, etc.
[TOC]
Cyklohexenstruktur
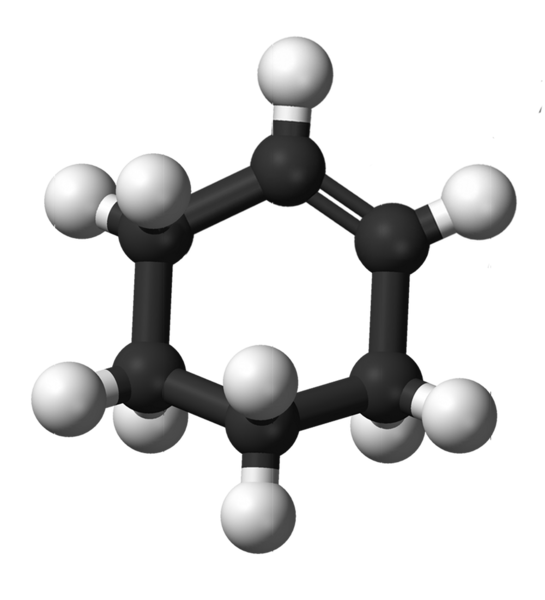 Cyklohexenstruktur. Källa: Kemikungen [Public Domain]
Cyklohexenstruktur. Källa: Kemikungen [Public Domain] Den övre bilden visar strukturen för cyklohexen med en modell av sfärer och staplar. Du kan märka sex -kolringen och dubbelbindningen, både omättnad av föreningen. Ur detta perspektiv verkar det som om ringen är platt; Men det är inte alls.
För att starta har dubbelbindning kol2, vilket ger dem en platt trigonal geometri. Därför finns dessa två kol, och de intill dem finns i samma plan; Medan de två kolen i motsatt ände (till dubbelbindningen) är över och under nämnda plan.
Kan tjäna dig: specifik tyngdkraftDen underordnade bilden illustrerar perfekt den nyligen förklarade.
 Framifrån av cyklohexenstrukturen. Källa: Ben Mills.
Framifrån av cyklohexenstrukturen. Källa: Ben Mills. Observera att den svarta remsan består av fyra kol: de två av dubbelbindningen och de andra intill dem. Det exponerade perspektivet är det som skulle erhållas om en åskådare placerade ögat precis framför den dubbla länken. Det kan då ses att ett kol är uppe och under detta plan.
Eftersom cyklohexenmolekylen inte är statisk, kommer de två kolhydrarna att bytas ut: den ena kommer att gå ner medan den andra kommer att stiga över planet. Så det förväntas bete sig denna molekyl.
Intermolekylär interaktioner
Cyclohexen är ett kolväte, och därför är dess intermolekylära interaktioner baserade på London -spridningskrafter.
Detta beror på att molekylen är apolär, utan permanent dipol, och dess molekylvikt är den faktor som de flesta bidrar till att hålla den sammanhängande i vätskan.
På samma sätt ökar dubbelbindningen graden av interaktion, eftersom den inte kan röra sig med samma flexibilitet som för de andra kolhydraterna, och detta gynnar interaktionen mellan angränsande molekyler. Det är av denna anledning som cyklohexen har en något större kokpunkt (83 ° C) än cyklohexan (81 ° C).
Egenskaper
Kemiska namn
Cyklohexen, tetrahydribenzen.
Molekylvikt
82,146 g/mol.
Fysiskt utseende
Färglös vätska.
Lukt
Söt lukt.
Kokpunkt
83 ºC till 760 mmHg.
Smältpunkt
-103,5 ºC.
antändningspunkt
-7 ºC (stängd kopp).
Vattenlöslighet
Praktiskt taget olöslig (213 mg/L).
Löslighet i organiska lösningsmedel
Belopp med etanol, bensen, koltetraklorid, oljeeter och aceton. Det förväntas kunna lösa upp apolära föreningar, såsom några av kolalotroperna.
Det kan tjäna dig: Torio: Struktur, egenskaper, erhållning, användningDensitet
0,810 g/cm3 vid 20 ° C.
Ångtäthet
2,8 (med luftrelation taget som lika med 1).
Ångtryck
89 mmHg vid 25 ° C.
Självriktning
244 ºC.
Sönderfall
Det sönderdelas i närvaro av uransalter, under solljus och ultraviolett strålning.
Gegga
0,625 mpascal vid 25 ° C.
Förbränningsvärme
3.751,7 kJ/mol vid 25 ºC.
Förångningsvärme
30,46 kJ/mol vid 25 ºC.
Ytspänning
26,26 mn/m.
Polymerisation
Kan polymerisera under vissa förhållanden.
Lukttröskel
0,6 mg/m3.
Brytningsindex
1 4465 till 20 ºC.
pH
7-8 till 20 ° C.
Stabilitet
Cyclohexen är inte särskilt stabil under långvarig lagring. Exponering för ljus och luft kan orsaka produktion av peroxider. Det är också oförenligt med starka oxiderande medel.
Reaktioner
-Cykloalques upplever huvudsakligen tilläggsreaktioner, både elektrofila och fria radikaler.
-Reagerar med brom till formulär 1.2-dibromocyklohexan.
-Det oxiderar snabbt i närvaro av kaliumpermanganat (KMNO4).
-Den kan producera en epoxid (cyklohexenoxid) i närvaro av peroxibensoesyra.
Syntes
Cyklohexen produceras genom syra cyklohexanolkatalys:
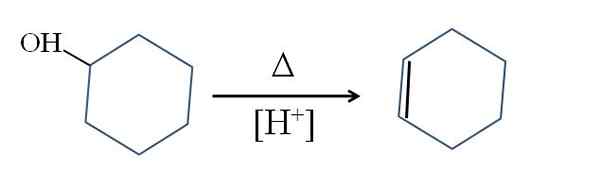 Uttorkning av cyklohexanolen. Källa: Gabriel Bolívar.
Uttorkning av cyklohexanolen. Källa: Gabriel Bolívar. Δ-symbolen representerar den värme som krävs för att främja utgången från OH-gruppen som en vattenmolekyl i ett surt medium (-OH2+).
Cyklohexen förekommer också genom partiell hydrering av bensen; Det vill säga, två av dess dubbelbindningar lägger till en vätemolekyl:
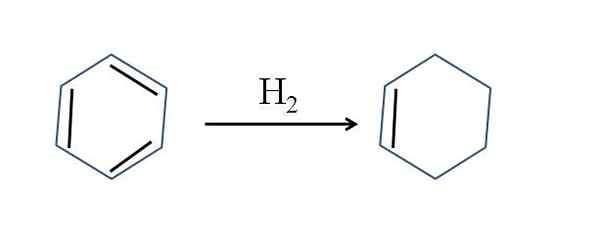 Partiell hydrering av bensen. Källa: Gabriel Bolívar.
Partiell hydrering av bensen. Källa: Gabriel Bolívar. Även om reaktionen verkar enkel kräver det bra h2 och katalysatorer.
Ansökningar
-Det har användbarhet som ett organiskt lösningsmedel. Dessutom är det ett råmaterial för produktion av adipinsyra, adipisk aldehyd, maleinsyra, cyklohexan och cyklohexylkarboxylsyra.
Kan tjäna dig: radioaktivitet-Det används vid produktion av cyklohexanklorid, förening som används som en mellanhand av beredningen av farmaceutiska produkter och gnuggar tillsatsmedel.
-Cyklohexen används också i syntesen av cyklohexanon, råmaterial för produktion av läkemedel, bekämpningsmedel, parfymer och färgämnen.
-Cyclohexen ingriper i syntesen av aminocyklohexanol, en förening som används som ytaktivt medel och emulgator.
-Dessutom kan cyklohexen användas för beredning i Butadieno -laboratoriet. Denna sista förening används vid tillverkning av syntetiskt gummi, i utarbetandet av bildäck, och används också i utarbetandet av akrylplast.
-Cyclohexen är råmaterial för lysinsyntes, fenol, polykyloolefinharts och gummitillsatser.
-Det används som en stabilisator av bensin med hög oktan.
-Ingriper i syntesen av vattentäta beläggningar, filmer som är resistenta mot sprickor och bindande mappar för beläggningar.
Risker
Cyclohexen är inte en mycket giftig förening, men den kan orsaka genom att kontakta en rodnad i huden och ögonen. Dess inandning kan ge hosta och dåsighet. Dessutom kan intag orsaka dåsighet, andningssvårigheter och illamående.
Cyclohexen är lite absorberad i mag -tarmkanalen, så allvarliga systemiska effekter förväntas inte på grund av dess intag. Den maximala komplikationen är dess ambition för andningsorganen, som kan producera kemisk lunginflammation.
Referenser
- Joseph f. Chiang och Simon Harvey Bauer. (1968). Molekylstruktur av cyklohexen. J. A.M. Kem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyklohexen: faror, syntes och struktur. Studie. Återhämtat sig från: studie.com
- Morrison, r. T. Och Boyd, r. N. (1987). Organisk kemi. (5ta Utgåva.). Redaktör Addison-Wesley Iberoamericana.
- Pub. (2019). Cyklohexen. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Kemisk bok. (2019). Cyklohexen. Återhämtat sig från: Chemicalbook.com
- Toxicology Data Network. (2017). Cyklohexen. Toxnet. Återhämtat sig från: toxnet.Nlm.Nih.Gov
- Kemoxi. (s.F.). Den strukturella formeln för cyklohexen är. Återhämtat sig från: kemoxi.com

