Cyklooxygenasstyper, reaktion, hämmare
- 2297
- 551
- Johan Eriksson
De cyklooxygenaser (COXS), även känd som prostaglandin H -syntas eller prostaglandin endoperoxidsyntes, är syrenasfettsyraenzymer som tillhör myeloperoxidas superfamilj och finns i alla ryggradsdjur.
Cykoxygenaser är bifunktionella enzymer, eftersom de har två olika katalytiska aktiviteter: en cyklooxygenasaktivitet och ett annat peroxidas, vilket gör att de kan katalysera Bis-Syregenering och Arachidonsyrareduktion för att bilda prostaglandin.
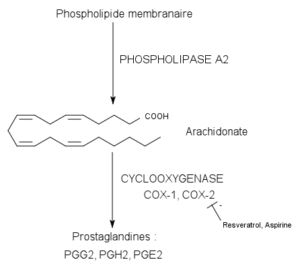 Kataliserad reaktion av cykloxygenasenzymer (källa: Pancrat [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons)
Kataliserad reaktion av cykloxygenasenzymer (källa: Pancrat [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons) De har inte hittats i växter, insekter eller i encelliga organismer, utan i ryggradsceller dessa enzym, vesiklar, etc.
De första upptäckterna av de produkter som syntetiserades av cyklooxygenaserna gjordes i sperma vätskor, så man trodde ursprungligen att det var ämnen som producerades i prostata, varför de kallades "prostaglandins".
Idag är det känt att prostaglandiner syntetiseras i alla vävnader hos ryggradsdjur och till och med i organismer som inte har prostatakörtlar, och att de olika isomererna hos dessa molekyler har olika funktioner i olika fysiologiska och patologiska processer såsom feber, känslighet för de olika isomererna Känslighet för smärta eller algees, inflammation, trombos, mytogenes, vasodilatation och vasokonstriktion, ägglossning. njurfunktion etc.
[TOC]
Grabbar
Förekomsten av två typer av cyklooxygenaser mellan ryggradsdjur har rapporterats. Den första som upptäcktes och renas är känd som Cox-1 eller helt enkelt Cox och renades först 1976 från Seminal Vesicles of Sheep and Cows.
Det andra cykloxigenaset som upptäcktes bland eukaryoterna var COX-2, 1991. Hittills har det bevisats att alla ryggradsdjur, inklusive broskfisk, benfisk, fåglar och däggdjur, har två gener som kodar för Cox -enzymer.
Det kan tjäna dig: svampcirkulation: näringsämnen, ämnen, osmoregulationEn av dem, Cox-1, Kodar för cyklooxigenas 1, vilket är konstitutivt, medan genen Cox-2 kodar för inducerbart cyklooxygenas.
Egenskaper hos båda generna och deras enzymatiska produkter
COX-1 och COX-2-enzymer är ganska lika, vilket förstås som 60-65% likhet mellan dess aminosyrasekvenser.
Generna Cox-1 Ortologer (gener i olika arter som har samma ursprung) i alla arter av ryggradsdjur producerar COX-1-proteiner som delar upp till 95% av identiteten hos deras aminosyrasekvenser, vilket också är sant för ortologerna för Cox-2, vars produkter delar mellan 70 och 90% identitet.
Cnidarians och ascidias har också två gener Cox, Men dessa skiljer sig från andra djur, så vissa författare antar att dessa gener kunde ha dykt upp i oberoende dupliceringshändelser från samma gemensamma förfader.
Cox-1
Genen Cox-1 väger cirka 22 kb och uttrycks konstitutivt för att koda COX-1-proteinet, som har cirka 600 aminosyravfall innan det bearbetas, eftersom det har en hydrofob signalpeptid efter vars avlägsnande betalar ett protein på cirka 576 aminosyror.
Detta protein är främst i endoplasmiska retikulum och dess allmänna struktur är i form av en homodimer, det vill säga två identiska polypeptidkedjor som är associerade för att bilda det aktiva proteinet.
Cox-2
Genen Cox-2, å andra sidan, väger cirka 8 kb och dess uttryck induceras av cytokiner, tillväxtfaktorer och andra ämnen. Detta kodar för COX-2-enzymet som det har, inklusive signalpeptiden, 604 aminosyravfall och 581 efter bearbetning.
Kan tjäna dig: anaerob andningDetta enzym är också homodimer och ligger mellan endoplasmatisk retikulum och kärnkraftsförpackningen.
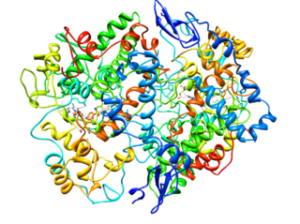 Molekylstruktur av typ 2-cykloxygenas (COX-2) (Källa: Cytokrom C på engelska Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons)
Molekylstruktur av typ 2-cykloxygenas (COX-2) (Källa: Cytokrom C på engelska Wikipedia [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons) Från analysen av deras strukturer har det fastställts att COX-1 och COX-2-enzymet engelska Epidermal tillväxtfaktor).
I denna modul finns extremt bevarade disulfidbindningar eller broar, som fungerar som ”dimeriseringsdomän” mellan de två polypeptiderna i varje homodimericenzym.
Proteiner har också amfipatiska propeller som underlättar förankring till ett av membranlagren. Dessutom har den katalytiska domänen för båda två aktiva ställen, en med cyklooxygenasaktivitet och en annan med peroxidasaktivitet.
Båda enzymerna är extremt bevarade proteiner, som är bland olika arter små signifikanta skillnader med avseende på mekanismerna för dimerisering och förening till membranet, liksom vissa egenskaper hos deras katalytiska domäner.
Cox -proteiner har dessutom glykosyleringsplatser som är viktiga för deras drift och som är absolut bevarade.
Reaktion
Cykloxygenasenzymer 1 och 2 ansvarar för att katalysera de två första stegen i prostaglandinbiosyntes, som börjar med omvandlingen av arakidonsyra till föregångare till prostaglandiner kända som hydroperoxi-endoperoxid PGG2.
För att dessa enzymer ska utöva sina funktioner måste de först aktiveras genom en process beroende på deras peroxidasaktivitet. Med andra ord beror dess huvudaktivitet på reduktionen av ett peroxidsubstrat (medierat av det aktiva peroxidasstället) så att oxidationen av järnet associerat med hemo -gruppen som fungerar som en kofaktor inträffar.
Det kan tjäna dig: Monera Kingdom: Egenskaper, klassificering och exempelOxidationen av hemo -gruppen orsakar bildning av en tyrosil -radikal i det aktiva stället cyklooxygenas, som aktiverar enzymet och främjar initieringen av cyklooxygenasreaktionen. Denna aktiveringsreaktion kan endast uppstå en gång, eftersom tyrosil -radikalen regenereras under den sista reaktionen av rutten.
Hämmare
Cyklooxygenaser är involverade i syntesen av prostaglandiner, som är hormoner med funktioner i skyddet av tarmslemhinnan, i aggregering av blodplättar och i regleringen av njurfunktion, utöver att delta i processerna för inflammation, smärta och feber och feber.
Med tanke på det faktum att dessa enzymer är nyckeln till produktionen av dessa hormoner, särskilt de som har att göra med inflammatoriska processer, har många farmakologiska studier fokuserat på hämning av cyklooxygenaser.
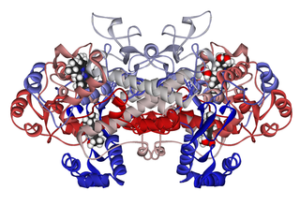 Molekylär struktur av cykloxigenas 1 kopplad till ibuprofen (källa: Fvasconcellos 5 maj 2007 [Public Domain] via Wikimedia Commons)
Molekylär struktur av cykloxigenas 1 kopplad till ibuprofen (källa: Fvasconcellos 5 maj 2007 [Public Domain] via Wikimedia Commons) Således har det visats att verkningsmekanismen för många icke-steroida antiinflammatoriska läkemedel har att göra med irreversibla eller reversibla (hämmande) acetylering av det aktiva stället cyklooxigenas i dessa enzymer.
Bland dessa läkemedel är piroxicam, ibuprofen, aspirin, flurbiprofen, diclofenac, naproxen och andra.
Referenser
- Boging, r. M. (2006). Hämmare av cyklooxygenaser: mekanismer, selektivitet och användning. Journal of Physiology and Pharmacology, 57, 113.
- Chandrasekharan, n. V., & Simmons, D. L. (2004). Cyklooxygenaserna. Genome Biology, 5 (9), 241.
- Fitzpatrick, f. TILL. (2004). Cyklooxygenasenzymer: reglering och funktion. Aktuell farmaceutisk design, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, L., & Fulton, till. M. (2002). Cyklooxygenasinhibitorer blockerar celltillväxt, ökar ceramid och hämmar cellcykeln. Bröstcancerforskning och behandling, 76 (1), 57-64.
- Rauzer, c. TILL., & Marnett, L. J. (2009). Cyklooxygenaser: strukturella och funktionella insikter. Journal of Lipid Research, 50 (tillägg), S29-S34.
- Vane, J. R., Bakhle och. S., & Botting, r. M. (1998). Cyclooxygenses 1 och 2. Årlig översyn av farmakologi och toxikologi, 38 (1), 97-120.

