Molekylär struktur Cyanhydronsyra, egenskaper, användningar

- 3902
- 347
- PhD. Lennart Johansson
han hydrocyansyra o Vätecyanid är en organisk förening vars kemiska formel är HCN. Det är också känt som metanonitril.
Cyanhydronsyra är en färglös, extremt giftig gas, som erhålls vid behandling av cyanider med syror. Denna syra ligger i det fredliga fröet, även känt på många ställen som en persika.
 Persikfrö, som innehåller vätecyanid eller vätecyanid, HCN. En.Ha [cc by-sa 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons.
Persikfrö, som innehåller vätecyanid eller vätecyanid, HCN. En.Ha [cc by-sa 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons. Vid en omgivningstemperatur är mindre än 25 ºC en vätska och över den temperaturen är en gas. I båda fallen är det extremt giftigt för människan, djur och till och med majoriteten av mikroorganismer som inte acklimatiseras till det. Det är ett bra lösningsmedel för joner. Det är väldigt instabilt eftersom det tenderar att lätt polymerisera.
Det finns i grönsaksriket som ingår i molekylerna i vissa glukosider, för när de hydrolyseras av enzymer av grönsaken erhålls HCN, glukos och bensaldehyd.
Dessa glukosider är inne i frön från vissa frukter som persikor, aprikos, körsbär, plommon och i bittera mandlar, så de bör aldrig intas.
Det finns också i växter som vissa typer av sorghum. Dessutom producerar vissa bakterier det under sin ämnesomsättning. Det används mest i polymerproduktion och i vissa metallurgiska processer.
HCN är ett dödligt gift på grund av inandning, intag och kontakt. Det finns i röken från cigaretten och i röken av elden av plast och material som innehåller kol och kväve. Det anses vara ett luftförorenande att inträffa under förbränning av organiskt material från omfattande områden på planeten.
[TOC]
Molekylstruktur och elektronisk konfiguration
Vätecyanid eller cyanidsyra är en kovalent, molekylär förening, med en väteatom, en kol och en kväve.
Kol- och kväveatomen delar 3 par elektroner, så de bildar en trippellänk. Väte är kopplat till kol, som med denna union presenterar sin Valencia de Cuatro och dess kompletta elektronoktett.
Kväven presenterar en fem Valencia på fem och för att slutföra sin oktet har ett par försvunnna eller ensamma elektroner som finns i sidled.
HCN är därför en helt linjär molekyl, med ett par saknade elektroner som ligger i sidled i kväve.
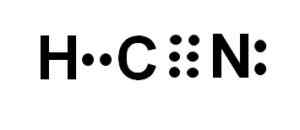 Lewis -representation av cyanhydronsyran, där elektronerna delas i varje bindning och paret av ensamma kvävelektroner observeras. Författare: Marilú Stea.
Lewis -representation av cyanhydronsyran, där elektronerna delas i varje bindning och paret av ensamma kvävelektroner observeras. Författare: Marilú Stea. 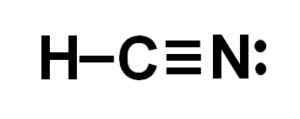 Vätecyanid- eller vätecyanidstruktur där trippelbindningen mellan kol och kväve observeras. Författare: Marilú Stea.
Vätecyanid- eller vätecyanidstruktur där trippelbindningen mellan kol och kväve observeras. Författare: Marilú Stea. Nomenklatur
- Hydrocyansyra
- Vätecyanid
- Metanonitril
- Formonitril
- Hydrocyansyra
Egenskaper
Fysiskt tillstånd
Under 25,6 ºC, om den är vattenfri och stabiliserad, är den en mycket instabil och giftig ljusblå vätska eller blå. Om det är över att temperaturen är en extremt giftig färglös gas.
Molekylvikt
27.03 g/mol
Smältpunkt
-13.28 ºC
Kokpunkt
25.63 ºC (Observera att den kokar precis över omgivningstemperaturen).
Flampunkt
-18 ºC (stängd koppmetod)
Självriktningstemperatur
538 ºC
Kan tjäna dig: gaskromatografiDensitet
0,6875 g/cm3 vid 20 ºC
Löslighet
Helt blandbar med vatten, etylalkohol och etyleter.
Dissociationskonstant
K = 2,1 x 10-9
Pktill = 9.2 (det är en mycket svag syra)
Vissa kemiska egenskaper
HCN har en mycket hög dielektrisk konstant (107 till 25 ° C). Detta beror på att deras molekyler är mycket polära och är associerade med vätebroar, som i fallet med vatten h2ANTINGEN.
För att ha en så hög dielektrisk konstant visar HCN vara ett bra joniserande lösningsmedel.
Den flytande vattenfri HCN är mycket instabil, den tenderar att våldsamt polymerisera. För att undvika detta läggs stabilisatorer till, som en liten procentandel av h2Sw4.
I vattenlösning och i närvaro av ammoniak och högtrycksadeninform, förening som är en del av DNA och RNA, det vill säga en biologiskt viktig molekyl.
Det är en mycket svag syra, eftersom dess joniseringskonstant är mycket liten, så det är bara delvis i vatten som ger cyanidanjonen CN-. Bildar salter med baserna men inte med karbonater.
Hans vattenhaltiga lösningar som inte är skyddade från ljus är långsamt sönderdelade generering av ammoniumformiatri hcoonh4.
I lösning ger den en svag lukt av mandlar.
Korrosivitet
Eftersom det är en svag syra är den i allmänhet inte frätande.
HCN -vattenhaltiga lösningar som innehåller svavelsyra som stabilisator attackerar emellertid starkt stål vid temperaturer större än 40 ºC och rostfritt stål vid temperaturer större än 80 ° C.
Dessutom kan HCN utspädd vattenhaltiga lösningar orsaka kolstål även vid rumstemperatur.
Du kan också attackera vissa typer av gummi, plast och beläggningar.
Plats i naturen
Det är relativt rikligt i att växtriket är en del av glukosider.
Till exempel genereras det från tonsilin C6H5-CH (-CN) -O-glykos-glykos, sammansatt i bittera mandlar. Tonsilen är en cyanogen beta-glukosid, för när hydrolysiserad bildar den två glukosmolekyler, en av bensaldehyd och en av HCN. Enzymet som släpper dem är beta-glukoxidas.
Tonsilen finns i frön av persikor, aprikos, bittera mandlar, körsbär och plommon.
Vissa typer av sorghumväxter innehåller den cyanogena glukósidan som kallas Durrina (det vill säga p-hydroxi- (S) -Mandelonitrilo-beta-d-glukosid). Denna förening kan försämras genom två steg enzymatisk hydrolys.
Först durrinosa-enzymet som är endogent i sorghumväxter hydrolys med glukos och p-hydroxi- (S) -Mandelonitrilo. Sedan blir den senare snabbt gratis HCN och P-hydroxibenzaldehyd.
 Sorghumväxt med högt Durrina -innehåll. Ingen maskinläsbar författare tillhandahållen. Pethan antog (baserat på upphovsrättsanspråk). [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikipedia Commons.
Sorghumväxt med högt Durrina -innehåll. Ingen maskinläsbar författare tillhandahållen. Pethan antog (baserat på upphovsrättsanspråk). [CC BY-SA 3.0 (http: // Creativecommons.Org/licenser/BY-SA/3.0/]]. Källa: Wikipedia Commons. HCN ansvarar för sorgens motstånd mot skadedjur och patogener.
Detta förklaras av det faktum att Durrina och Durrinosa -enzymet har olika platser i dessa växter och kommer i kontakt endast när vävnaderna skadas eller förstörs, släpper HCN och skyddar infektionsväxten som kan tränga igenom den skadade parten.
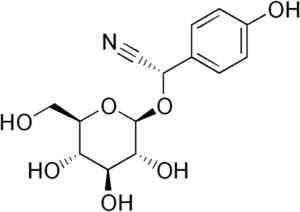 Durrina molekyl där trippel CN -bindningen observeras att genom enzymatisk hydrolys producerar HCN. EDGAR181 [Public Domain]. Källa: Wikipedia Commons.
Durrina molekyl där trippel CN -bindningen observeras att genom enzymatisk hydrolys producerar HCN. EDGAR181 [Public Domain]. Källa: Wikipedia Commons. Dessutom vissa patogena bakterier av människan, till exempel Pseudomonas aeruginosa och P. Gingivalis De producerar det under sin metaboliska aktivitet.
Ansökningar
Vid framställning av andra kemiska och polymerföreningar
Användningen som involverar det mesta av HCN som produceras på industriell nivå är beredningen av mellanhänder för organisk syntes.
Kan tjäna dig: järnoxid (ii): struktur, nomenklatur, egenskaper, användningarDet används i adiponitrilsyntes nc- (ch2)4-CN, som används för att förbereda nylon eller nylon, en polyamid. Det tjänar också till att förbereda Acrilonitrilo eller Cianoethylene Cho2= CH-CN, används för att förbereda akryl- och plastfibrer.
Dess derivat natriumcyanid används för återhämtning av guld vid gruvdrift av denna metall.
En annan av dess derivat Clcn -cyanogenklorid tjänar för bekämpningsmedelformler.
HCN används för framställning av kelaterande medel som EDTA (Ethylen-diamino-tetra-acetato).
Det tjänar för tillverkning av ferrocyanider och vissa farmaceutiska produkter.
Olika användningsområden
HCN -gas har använts som insektsmedel, fungicid och desinfektionsmedel, för fumigering av fartyg och byggnader. Också för att fumigera möbler för att återställa dem.
HCN har använts inom metallpolska.
För sin mycket höga toxicitet utnämndes han till kemiskt krigsmedel.
I jordbruket
Det har använts som herbicid och bekämpningsmedel i fruktträdgårdar. Han hade använt för att kontrollera skalor och andra patogener av citrusträd, men några av dessa skadedjur har blivit resistenta mot HCN.
Det har också använts för att fumigera spannmålssilo. Den gasformiga HCN som tillagats på platsen har använts vid rökning av vetekorn för att bevara dem från skadedjur som insekter, svampar och gnagare. För denna användning är det viktigt att frön som ska fumigeras till bekämpningsmedlet.
Tester som fumigerar vetefrön har gjorts med HCN och det har visat sig att spiringspotentialen för dessa inte påverkar negativt, snarare verkar det gynna det.
Höga doser av HCN kan emellertid avsevärt minska längden på små blad som växer ut från fröet.
Å andra sidan, på grund av att det är en kraftfull nematicide och att vissa sorghumväxter har den i sina vävnader, undersöks potentialen för sorghumväxter för att användas som biocidgrön gödselmedel.
Dess användning skulle tjäna till att förbättra jord, undertrycka ogräs och kontrollsjukdomar och skador orsakade av fytoparasitiska nematoder.
Risker
För människan är HCN ett dödligt gift på alla vägar: inandning, intag och kontakt.
 Författare: Clker-fri-vektorbilder. Källa: Pixabay.
Författare: Clker-fri-vektorbilder. Källa: Pixabay. Inhalerad kan vara dödlig. Det uppskattas att cirka 60-70% av befolkningen kan upptäcka lukten av bittera HCN-mandlar när den är i luften i en 1-5 ppm-koncentration.
Men det finns 20% av befolkningen som fortfarande inte kan upptäcka den vid dödliga koncentrationer för att vara genetiskt oförmögen att göra det.
Inagd är ett akut och omedelbart actiongift.
Om dina lösningar kommer i kontakt med huden kan tillhörande cyanid vara dödlig.
HCN är närvarande i cigarettröken och den som genereras när plast som innehåller kväve bränns.
Dödlig handlingsmekanism inom organismen
Det är en kemikalie och är snabbt giftig, vilket ofta leder till döden. När den kommer in i organismen förenar den metalloenzymerna (enzymer som innehåller en metalljon) inaktiverar dem. Det är ett giftigt medel för flera organ i människokroppen
Dess huvudsakliga toxiska effekt består i hämningen av cellulär andning, eftersom den inaktiverar ett enzym som påverkar fosforylering i mitokondrier, som är organeller som bland annat ingriper i andningsfunktionen av celler.
Kan tjäna dig: kaliumpermanganat (kmno4)Cigarettröksrisk
HCN finns i cigarettröken.
Även om många känner till effekten av att förgifta HCN, inser få människor att de utsätts för deras skadliga effekt genom cigarettrök.
HCN är en av orsakerna till hämningen av flera cellandel -enzymer. Mängden HCN som finns i cigarettröken har en skadlig effekt på nervsystemet.
HCN -nivåer har rapporterats i cigarettrök mellan 10 och 400 μg per cigarett för rök direkt och 0,006 till 0,27 μg/cigarett för sekundär inandning (passiv rökare). HCN ger toxiska effekter från 40 μm och framåt.
 Författare: Alexas Photos. Källa: Pixabay.
Författare: Alexas Photos. Källa: Pixabay. Att inhaleras kommer snabbt in i blodomloppet, där han släpps i plasma eller binder till hemoglobin. En liten del konverterar till Tiocianato och utsöndras av urin.
HCN -uppvärmningsrisker
Långvarig exponering för vätskans värme i stängda behållare kan orsaka våldsam och oväntad brott av dessa. Det kan explosivt polymerisera 50-60 ºC i närvaro av alkalispår och i frånvaro av hämmare.
Närvaro av HCN i brandrök
HCN frigörs under förbränning av polymerer som innehåller kväve, såsom ull, siden, polyakrylonitrilos och nylon, bland andra. Dessa material finns i våra hem och på de flesta platser för mänsklig aktivitet.
Av detta skäl kan HCN potentiellt vara dödsorsaken genom inandning.
Atmosfärförorenande
HCN är ett förorenande av troposfärer. Det är motståndskraftigt mot fotólysis och under atmosfärens miljöförhållanden lider inte hydrolys.
Åh hydroxylradikaler • Tillverkad fotokemiskt kan reagera med HCN, men reaktionen är mycket långsam, så Halvlivet för HCN i atmosfären är 2 år.
När biomassa brinner, särskilt mob, släpps HCN till atmosfären, och även under industriella aktiviteter. Emellertid är torvförbränning 5 till 10 gånger mer förorenande än att bränna annan typ av biomassa.
Vissa forskare har funnit att höga temperaturer och torka orsakade av El Niño -fenomenet i vissa områden på planeten förvärvar.
 Författare: Steve Buissinne. Källa: Pixabay.
Författare: Steve Buissinne. Källa: Pixabay. Detta leder till en intensiv förbränning av biomassa i torra stationer.
Dessa händelser är källan till höga koncentrationer av HCN i troposfären, som så småningom transporteras till den låga stratosfären, som är kvar under mycket lång tid.
Referenser
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- ELLER.S. National Library of Medicine. (2019). Vätecyanid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Gidlow, D. (2017). Vätecyanid-en uppdatering. Arbetsmedicin 2017; 67: 662-663. NCBI återhämtade sig.Nlm.Nih.Gov.
- Van Nostrands vetenskapliga encyklopedi. (2005). Vätecyanid. 9th Hämtad från online -biblioteket.Wiley.com.
- Ren och.-L. et al. (nitton nittiosex). Effekt av vätecyanid och karbonylsulfid på spiring och plumule vigor av vete. Pest. Sci. 1996, 47, 1-5. Hämtad från online -biblioteket.Wiley.com.
- Från Nicola, G.R. et al. (2011). Till enkel analysmetod för utvärdering av dhurrininnehåll i cyanogena växter för deras användning i foder och biofumigering. J. Jordbruks-. Matkeme. 2011, 59, 8065-8069. Återhämtat sig från pubar.ACS.org.
- Sheese, s.OCH. et al. (2017). En global förbättring av vätecyanid i den nedre stratosfären Throupout 2016. Geofor. Nötkött. Lett., 44, 5791-5797. Återhämtat sig från agupubs.Onlinebibliotek.Wiley.com.
- Surleva, a.R. och Drochioiu, G. (2013). Visualiseringsrökningsrisk: Enkel spektrofotometrisk bestämning av vätecyanid i cigarettrök och filter. J. Kem. Utbildare. 2013, 90, 1654-1657. Återhämtat sig från pubar.ACS.org.
- Alarie och. et al. (1990). Roll av vätecyanid i mänskliga dödsfall i eld. I eld och polymerer. Kapitel 3. ACS Symposium Series. Återhämtat sig från pubar.ACS.org.
- « Krominsyrastruktur, egenskaper, erhållning, användning
- 8 experiment med mycket kontroversiella människor »

