Krominsyrastruktur, egenskaper, erhållning, användning

- 4864
- 1377
- Per Eriksson
han krominsyra eller h2Cro4 Syran associerad med kromoxid (VI) eller CRO -kromicoxid är teoretiskt3. Detta valör beror på det faktum att i de sura vattenhaltiga lösningarna av kromoxiden hindras arten h2Cro4 Det är närvarande med andra kromarter (VI).
Kromicoxid3 Det kallas också vattenfri kromsyra. CRO3 Det är ett rödaktigt eller lila brunt fast ämne som erhålls vid behandling av kaliumdikromatlösningar K2Cr2ANTINGEN7 Med svavelsyra h2Sw4.
 Cromic Oxide Crushes3 I en smältkanna. Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons.
Cromic Oxide Crushes3 I en smältkanna. Rando Tuikene [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons. Vattenhaltig kromoxidlösningar upplever en balans mellan vissa kemiska arter vars koncentration beror på lösningens pH. Grundläggande pH dominerar cromatjoner CRO42-, Medan Hcrosyrajoner dominerar4- och cr dicromato2ANTINGEN72-. Det uppskattas att sur syra också är närvarande kromsyra h2Cro4.
På grund av dess stora oxiderande kraft används krominsyralösningar i organisk kemi för att utföra oxidationsreaktioner. De används också i elektrokemiska processer för att behandla metaller så att de får motstånd mot korrosion och slitage.
Vissa polymermaterial behandlas också med kromsyra för att förbättra deras vidhäftning till metaller, målningar och andra ämnen.
Krominsyralösningar är mycket farliga för både människor och de flesta djur och miljön. Av denna anledning behandlas de flytande eller fasta processerna avfall där kromsyra används för att eliminera krom (VI) -rester eller för att återvinna alla närvarande krom och regenerera kromsyra för att återanvända den.
[TOC]
Strukturera
Krominsyramolekylen h2Cro4 Det bildas av en cromato -jon42- och två vätejoner h+ Förenade detta. I kromatjonen är kromelementet i ett +6 oxidationstillstånd.
Kromatjonens rumsliga struktur är tetraedral, där krom är i mitten och syre upptar tetrahedrons fyra vertikaler.
I krominsyran är väteatomer vardera bredvid ett syre. Av de fyra krombindningarna med syreatomerna är två dubbla och två är enkla, eftersom de har hydrogener som är förenade med dem.
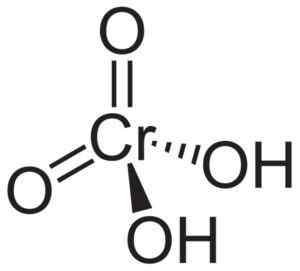 Krominsyrestruktur h2Cro4 där den tetraedrala formen av kromat och dess dubbelbindningar observeras. Neuroteker [Public Domain]. Källa: Wikipedia Commons.
Krominsyrestruktur h2Cro4 där den tetraedrala formen av kromat och dess dubbelbindningar observeras. Neuroteker [Public Domain]. Källa: Wikipedia Commons. Å andra sidan Cro -Croomic Oxide3 Den har en oxidationskromatom +6 omgiven av bara tre syreatomer.
Nomenklatur
- Cromic acid h2Cro4
- Tetraoxokromsyra h2Cro4
- Cromic Oxide (vattenfri kromsyra) CRO3
- Kromtrioxid (vattenfri kromsyra) CRO3
Egenskaper
Fysiskt tillstånd
Anhydro eller kromoxid Krominsyra är ett kristallint fast ämne till rött
Molekylvikt
Cro3: 118,01 g/mol
Smältpunkt
Cro3: 196 ºC
Ovanför smältpunkten är termiskt instabil, den förlorar syre (det är reducerat) att ge kromoxid (iii) Cr2ANTINGEN3. Den sönderdelas vid cirka 250 ºC.
Densitet
Cro3: 1,67-2,82 g/cm3
Löslighet
CRO3 Det är mycket lösligt i vatten: 169 g/100 g vatten vid 25 ºC.
Det är lösligt i mineralsyror som svavel och kväve. Alkohol.
Andra egenskaper
CRO3 Det är väldigt hygroskopiskt, dess kristaller är läckra.
När CRO3 Det löses upp i vattenformar starkt sura lösningar.
Kan tjäna dig: titan: historia, struktur, egenskaper, reaktioner, användningarDet är en mycket kraftfull oxidant. Oxy kraftigt organiskt material i nästan alla dess former. Attackerar tyget, läder och lite plast. De flesta metaller attackerar också.
Det är starkt giftigt och mycket irriterande på grund av dess höga oxidationspotential.
Kemi för vattenhaltiga lösningar där kromsyra finns
Kromicoxid3 Det löses snabbt i vatten. I vattenlösning kan krom (VI) existera i olika joniska former.
En pH> 6,5 eller i Alkaline Solution Chrome (VI) förvärvar Cromato -jonformen42- gul.
Om pH minskas (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , som kan dimerisera till jon dikromato cr2ANTINGEN72-, Och lösningen blir orange. Vid pH mellan 2,5 och 5,5 är de dominerande arterna HCRO4- och cr2ANTINGEN72-.
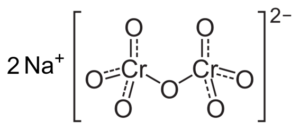 Cr -dikromatjonstruktur2ANTINGEN72- som ligger bredvid två natrium -nonjoner+. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons.
Cr -dikromatjonstruktur2ANTINGEN72- som ligger bredvid två natrium -nonjoner+. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons. Balanserna som förekommer i dessa lösningar när pH går ner är följande:
Cro42- (kromatjon) + h+ ⇔ Hcro4-
Hcro4- + H+ ⇔ h2Cro4 (kromsyra)
2HCRO4- ⇔ cr2ANTINGEN72- (Dicromate jon) + h2ANTINGEN
Dessa balanser inträffar endast om syran som tillsätts för att sänka pH är3 eller hclo4, För med andra syror bildas olika föreningar.
De sura lösningarna av dikromat är mycket energiska oxiderande medel. Men i alkaliska lösningar är kromatjonen mycket mindre oxidant.
Erhållande
Enligt de konsulterade källorna är ett av sätten att få Cro Cromic Oxide3, Detta består av att tillsätta svavelsyra till en vattenhaltig lösning av natrium- eller kaliumdikromat, och bildar en rödorange fällning.
 Cromic oxid hydratiserad eller kromsyra. Himstakan [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons.
Cromic oxid hydratiserad eller kromsyra. Himstakan [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons. Cromic acid h2Cro4 Det finns i vattenhaltiga kromoxidlösningar i surt medium.
Krominsyraanvändningar
Vid oxidation av kemiska föreningar
På grund av dess starkt oxiderande kapacitet har kromsyra använts under lång tid och framgångsrikt för att oxidera organiska och oorganiska föreningar.
Bland otaliga exempel är följande: det tillåter oxidation av primära alkoholer till aldehydos och dessa till karboxylsyror, alkoholer som är sekundära till ketoner, toluen till bensoesyra, etylbensen till acetofenon, trifenylmetan till trifenylcarbinol, formisk syra en ko -kol2, oxalsyra till CO2, mjölksyra till acetaldehyd och co2, Järntro2+ En järn tro tro tro3+, jonjodid till jod, etc.
Tillåter omvandling av kväve-omfattande till nitro-föreningar, sulfider till sulfoner. Det ingriper i syntesen av ketoner baserade på alkener, som oxiderade de hydroborerade alkenerna till ketoner.
Föreningar mycket resistenta mot vanliga oxidanter, såsom syre eller2 eller väteperoxid h2ANTINGEN2, De oxideras av kromsyra. Detta är fallet med vissa heterocykliska bastesses.
I metallanodiseringsprocesser
Krominsyraanodisering är en elektrokemisk behandling som gäller för aluminium för att skydda den under många år från oxidation, korrosion och slitage.
Anodiseringsprocessen involverar elektrokemisk bildning av ett skikt av aluminiumoxid eller aluminiumoxid vid metall. Detta skikt förseglas sedan i varmt vatten, vilket uppnås genom omvandling till trihydratiserad aluminiumoxid.
Det förseglade oxidskiktet är tjockt, men det är strukturellt svagt och inte särskilt tillfredsställande för efterföljande limföreningar. Men genom att tillsätta en liten mängd kromsyra till tätande vatten utvecklas en yta som kan bilda bra bindningar.
Kan tjäna dig: lag om bevarande av materiaKrominsyra vid tätning av vatten löser upp en del av den tjocka cellstrukturen och lämnar en tunn, stark, fast fäst vid aluminiumoxid, till vilken limet fastnar och bildar starka och varaktiga leder.
Anodisering med kromsyra gäller också titan och dess legeringar.
I kemiska omvandlingsbehandlingar
Krominsyra används i metallbeläggningsprocesser genom kemisk omvandling.
Under denna process är metaller nedsänkta i kromsyralösningar. Detta reagerar och löser delvis ytan som deponerar samtidigt ett tunt skikt av komplexa kromföreningar som interagerar med basmetallen.
Denna process kallas kromatomvandlingsbeläggning eller konverteringskrom.
Metallerna som vanligtvis utsätts för omvandlingskrom är olika typer av stål, såsom kolstål, rostfritt stål och zinkbelagda stål, och flera icke -järnmetaller, såsom magnesiumlegeringar, tennlegeringar, aluminiumlegeringar, koppar, kadmium, mangan och silver.
Denna behandling ger korrosion och ljusstyrka motstånd mot metall. Ett högre pH i processen större motstånd mot korrosion. Temperaturen påskyndar syrareaktionen.
Beläggning av olika färger kan appliceras, såsom blått, svart, guld, gult och transparent. Det ger också bättre vidhäftning av metallytan mot målningar och lim.
I eroderad eller hackad yta
Krominsyralösningar används vid framställningen av ytan på termoplastiskt material, termosystibla polymerer och elastomerer för senare beläggning med målningar eller lim.
H2Cro4 uppnår en effekt på ytkemi och dess struktur, eftersom det hjälper till att öka dess grovhet. Kombinationen av bitar och oxidation ökar penetrationen av lim och kan till och med orsaka förändringar i polymeregenskaperna.
Det har använts för att erodera grenad polyeten med låg densitet, hög densitet och polypropen linjär polyeten.
Det används mycket i elektro-mottagaren eller galvanoplastiksindustrin för att underlätta vidhäftning av metallpolymer.
I flera användningsområden
Krominsyra används som ett träbevarande, även i magnetiska material och för kemiska reaktioner Katalys.
Återvinning av krominsyra
Det finns många processer som använder krominsyra och genererar strömmar eller rester som innehåller krom (III) som inte kan kasseras eftersom de har kromjoner (VI) som är mycket giftiga eller återanvändning eftersom koncentrationen av kromatjoner är mycket låg.
Dess disposition kräver kemisk reduktion av kromater till krom (iii) följt av hydroxid- och filtreringsutfällning, vilket genererar ytterligare kostnader.
Av denna anledning har olika metoder studerats för att ta bort och återhämta kromater. Här är några av dessa.
Genom hartser använder
Under många år har jonbyteshartser för kromat förorenad vattenbehandling använts. Detta är en av de behandlingar som godkänts av den amerikanska miljöskyddsbyrån, eller EPA (akronym för engelska Miljöskyddsbyrå).
Denna metod möjliggör återvinning av koncentrerad kromsyra eftersom den regenereras igen från hartset.
Hartser kan vara starka eller svaga bas. I starkt grundläggande hartser kan kromaten tas bort som HCRO -joner4- och cr2ANTINGEN72- De byts ut med OH -joner- och cl-. I svagt bashartser, till exempel sulfat, utbyts joner med SOS42-.
Kan tjäna dig: nepelometriNär det gäller starkt grundläggande hartser är R- (OH), globala reaktioner är följande:
2roh + HCRO4- + H+ ⇔ r2Cro4 + 2h2ANTINGEN
R2Cro4 + 2HCRO4- ⇔ 2RHCRO4 + Cro42-
R2Cro4 + Hcro4- + H+ ⇔ r2Cr2ANTINGEN7 + H2ANTINGEN
För varje mol av r2Cro4 Konvertering av en mol av CR (vi) av lösningen tas bort, vilket gör denna metod mycket attraktiv.
Efter avlägsnande av kromaterna behandlas hartset med en starkt alkalisk lösning för att regenerera dem på ett säkert ställe. Sedan omvandlas kromaterna till koncentrerad kromsyra för att återanvändas.
Genom elektrokemisk regenerering
En annan metod är den elektrokemiska regenereringen av kromsyra, som också är ett mycket bekvämt alternativ. Genom denna procedur oxideras krom (III) till krom (VI). Anodmaterialet i dessa fall är företrädesvis bly dioxid.
Användning av mikroorganismer för att rensa ut avloppsvatten med kromsyra kvarstår
En metod som har undersökts och som fortfarande studeras är användningen av mikroorganismer som finns naturligt i vissa avloppsvatten förorenade med hexavalenta kromjoner som är innehållet i kromsyralösningar.
 Skadliga avloppsvatten för miljön. Författare: OpenClipart-Vectors. Källa: Pixabay.
Skadliga avloppsvatten för miljön. Författare: OpenClipart-Vectors. Källa: Pixabay. Sådan är fallet med vissa bakterier som finns i garvningsavloppsvatten. Dessa mikrober har studerats och fastställts att de är resistenta mot kromater och också kan reducera krom (vi) till krom (iii) vilket är mycket mindre skadligt för miljön och levande varelser.
Av denna anledning uppskattas att de kan användas som en miljövänlig metod för sanering och avgiftning av avloppsvatten förorenade med kromsyra kvarstår.
Krominsyrarrisker och kromoxid
CRO3 Det är inte bränsle men kan intensifiera förbränningen av andra ämnen. Många av dina reaktioner kan orsaka eld eller explosion.
CRO3 och krominsyralösningar är kraftfull irriterande hud (de kan orsaka dermatit), ögon (kan bränna dem) och slemhinnor (kan orsaka bronkasma) och kan orsaka så kallade "kromhålor" i andningsorganen.
Kromföreningar (VI) såsom kromsyra och kromoxid är allvarligt giftiga, mutagena och cancerframkallande för de flesta levande varelser.
Referenser
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- ELLER.S. National Library of Medicine. (2019). Krominsyra. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wegman, r.F. och van Twisk, J. (2013). Aluminium- och aluminiumlegeringar. 2.5. Krominsyraanodiseringsprocess. I ytberedningstekniker för limbindning (andra upplagan). Återhämtat sig från Scientedirect.com.
- Wegman, r.F. och van Twisk, J. (2013). Magnesium. 6.4. Beredning av magnesium- och magnesiumlegeringar genom kromsyrabehandlingsprocesser. I ytberedningstekniker för limbindning (andra upplagan). Återhämtat sig från Scientedirect.com.
- Grot, w. (2011). Ansökningar. 5.1.8. Krominsyraförnyelse. I fluorerade jionomerer (andra upplagan). Återhämtat sig från Scientedirect.com.
- Swift, K.G. och Booker, J.D. (2013). Ytteknikprocess. 9.7. Kromaterande. I tillverkningsprocessvalet handbok. Återhämtat sig från Scientedirect.com.
- Poulson, A.H.C. et al. (2019). Ytmodifieringstekniker för PEEK, inklusive plasmaytbehandling. elva.3.2.1. Ytetsning. I Peek Biomaterial Handbook (andra upplagan). Återhämtat sig från Scientedirect.com.
- Westheimer, f.H. (1949). Mekanismerna för kromsyraoxidationer. Chemical Reviews 1949, 45, 3, 419-451. Återhämtat sig från pubar.ACS.org.
- Tan, h.K.S. (1999). Krominsyrasemalation med anjonbyte. Canadian Journal of Chemical Engineering, Volym 77, februari 1999. Hämtad från online -biblioteket.Wiley.com.
- Kabir, m.M. et al. (2018). Isolering och karakterition av krom (VI) -reducerande bakterier från garveriutsläpp och fast avfall. World Journal of Microbiology and Biotechnology (2018) 34: 126. NCBI återhämtade sig.Nlm.Nih.Gov.
- « Industriella landskapsegenskaper, element och exempel
- Molekylär struktur Cyanhydronsyra, egenskaper, användningar »

