Myrsyra (HCOOH)
- 2073
- 371
- Hans Olsson
Vi förklarar vad som är myrsyra, dess egenskaper, struktur och tillämpningar
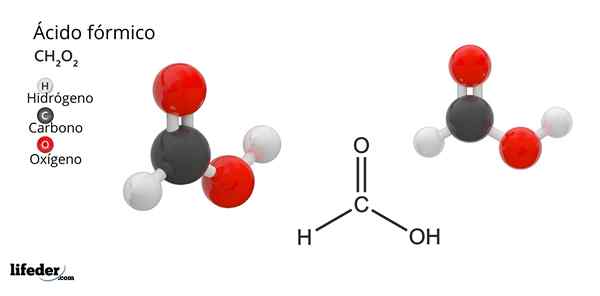
 Formel och struktur av myrsyra
Formel och struktur av myrsyra Vad är myrsyra?
han myrsyra eller metansyraDet är den enklaste och lilla föreningen av alla organiska syror. Det är också känt som metansyra och dess molekylformel är HCOOH, med bara en väteatom kopplad till kolatomen. Hans namn härstammar från ordet formik, som på latin betyder myra.
Naturalisterna från det femtonde århundradet fann att vissa typer av insekter (formen kik), såsom myror, termiter, bin och skalbaggar, utsöndrar denna förening som ansvarar för deras smärtsamma hackade. Dessa insekter använder också myrsyra som en mekanism för attack, försvar och kemisk skyltning.
De har giftiga körtlar som utsöndrar detta och andra syror (till exempel ättiksyra) som en dagg utanför. Myrsyra är starkare än ättiksyra (Ch3COOH); Därför, upplöst i lika stora mängder i vatten, producerar myrsyra lösningar med lägre pH -värden.
Den engelska naturforskaren John Ray uppnådde isoleringen av den myrsyran 1671 och distribuerade den från stora mängder myror.
Å andra sidan utfördes den första framgångsrika syntesen av denna förening av den franska kemisten och fysikern Joseph Gay-Lussac, med hjälp av nattsyra (HCN) som ett reagens.
Var är myrsyra?
 Myror utsöndrar myrsyra
Myror utsöndrar myrsyra Myrsyra kan finnas på marknivåer, som en del av biomassa eller i atmosfären, involverad i ett brett spektrum av kemiska reaktioner; Det kan till och med hittas under jorden, inuti oljan eller i en gasfas på ytan.
När det gäller biomassa är insekter och växter de viktigaste generatorerna för denna syra. När fossila bränslen bränns producerar gasformiga myrsyra; Följaktligen släpper fordonsmotorer myrsyra till atmosfären.
Jorden är emellertid värd för ett orimligt antal myror, och bland alla dessa kan producera på ett år tusentals gånger mängden myrsyra som genereras av den mänskliga industrin. Även skogsbränder representerar gasformiga källor till myrsyra.
Det kan tjäna dig: litium: historia, struktur, egenskaper, risker och användningarOvan, i den komplexa atmosfäriska matrisen inträffar fotokemiska processer som syntetiserar myrsyra.
Vid denna tidpunkt bryts många flyktiga organiska föreningar (VOC) under effekterna av ultraviolett strålning, eller oxideras av fria radikala mekanismer OH. Den rika och komplexa atmosfäriska kemin är överlägset den dominerande källan till formell myrsyra.
Myrsyrastruktur
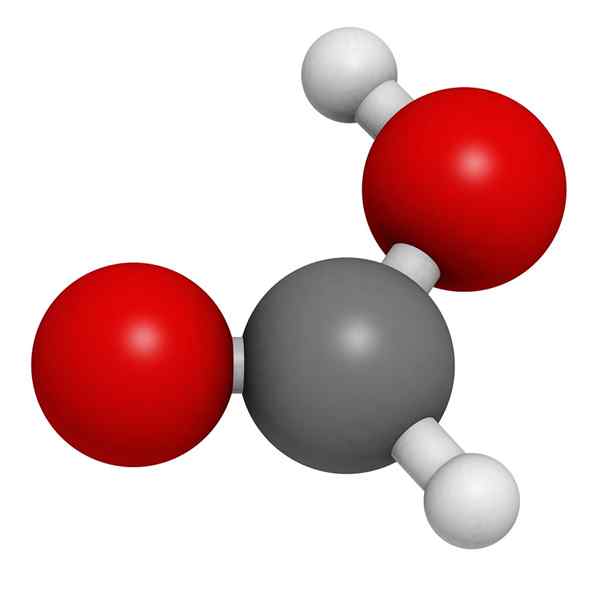 Molekylär myrsyra
Molekylär myrsyra I den överlägsna bilden illustreras strukturen för en gasfas av myrsyra. Vita sfärer motsvarar väteatomer, röda syre och svarta atomer till kolatomer.
I dessa molekyler kan två grupper uppskattas: hydroxyl (-OH) och formil (-ch = O), båda kan bilda vätebroar.
Dessa interaktioner är av O-H-O-typen, som är hydroxils-grupperna som givarna av H och grupperna formar givarna till OR.
H kopplat till kolatomen saknar dock denna kapacitet. Dessa interaktioner är mycket starka och på grund av atomen av H -fattiga i elektroner är väte i OH -gruppen surare; Därför stabiliserar detta väte ytterligare broar.
Som ett resultat av ovanstående finns myrsyra i en bultform och inte som en individuell molekyl.
Kristallstruktur
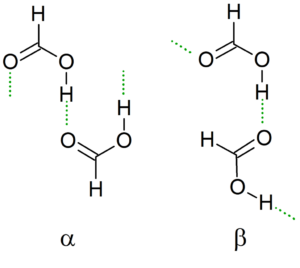
När temperaturen går, leder dimeren sina vätebroar för att generera den mest stabila möjliga strukturen tillsammans med de andra dimererna, vilket skapar oändliga kedjor α och ß av myrsyra.
En annan nomenklatur är "cis" och "trans" -konformatorerna. I det här fallet används "CIS" för att beteckna grupper orienterade i samma riktning, och "trans" för dessa grupper i motsatta adresser.
Kan tjäna dig: Tanteo Balance: Steg, exempel och övningarTill exempel, i a -kedjan, pekar de formila grupperna "till samma sida (vänster), i motsats till p -kedjan, där dessa formylgrupper pekar på motsatta sidor (överlägsen bild).
Denna kristallina struktur beror på de fysiska variablerna som verkar på den, såsom tryck och temperatur. Således är kedjor konvertibla; Det vill säga, under olika förhållanden kan en "cis" -kedja omvandlas till en "trans" -kedja, och vice versa.
Om trycket ökar till drastiska nivåer komprimeras kedjor tillräckligt för att betraktas som en kristallin polymer av myrsyra.
Myrsyraegenskaper
De fysiska och kemiska egenskaperna hos myrsyra nämns nedan:
- Myrsyra är en vätska vid rumstemperatur, färglös och med en stark och penetrerande lukt. Den har en molekylvikt på 46 g/mol, den smälter till 8,4 ° C och har en kokpunkt på 100,8 ºC, större än vatten för vatten.
- Det är blandbart i vatten och polära organiska lösningsmedel, såsom eter, aceton, metanol och etanol.
- Å andra sidan, i aromatiska lösningsmedel (såsom bensen och toluen) är det något lösligt, eftersom den myrsyran knappt har en kolatom i dess struktur.
- Den har en PKA på 3,77, mer syra än för ättiksyra, vilket kan förklaras eftersom metylgruppen ger elektronisk densitet till den oxiderade kolatomen av de två syre. Detta resulterar i en liten nedstigning i protonens surhet (ch3COOH, HCOOH).
- S (utan tvekan syran blir detta anjon HCOO -format-, som kan demociera den negativa belastningen mellan de två syreatomerna. Därför är det en stabil anjon och förklarar den stora surheten i myrsyra.
Reaktioner
Myrsyra kan dehydratiseras i kolmonoxid (CO) och vatten. I närvaro av platinakatalysatorer kan det också sönderdelas i molekylärt väte och koldioxid:
HCOOH (L) → H2(g) + co2(g)
Den här egenskapen gör att myrsyra kan betraktas som ett säkert sätt att lagra väte.
Myrsyraanvändningar/applikationer
Mat- och jordbruksindustrin
Trots hur skadlig myrsyra kan vara, används den vid adekvata koncentrationer som ett konserveringsmedel i mat på grund av dess antibakteriella verkan. Av samma anledning används den i jordbruket, där det också har en bekämpningsmedel.
Det presenterar också konserveringsmedel på betesmarker, vilket hjälper till att förhindra tarmgaser hos avelsdjur.
Textil- och skorindustrin
Det används i textilindustrin i färgning och förfining av textilier, kanske den vanligaste användningen av denna syra är.
Myrsyra används vid läderbearbetning på grund av dess eländiga verkan och i håret eliminering av detta material.
Trafiksäkerhet på vägar
Förutom det indikerade industriella användningen används de som härrör från formatsyra (format) i Schweiz och Österrike på vägar under vintern för att minska risken för olyckor. Denna behandling är effektivare än användningen av vanligt salt.
Referenser
- Tellus (1988). Atmosfärisk formell från formismyror: en preliminär bedömning408, 335-339.
- B. Hirs et al. (2015). Källor och sänkor av atmosfärisk myrsyra. Atmos. Kem. Fysik., 15, 6283-6304.
- Wikipedia. (2018). MYRSYRA. Hämtas från.Wikipedia.org
- Aktiva. MYRSYRA. Återhämtat sig från Actipedia.org
- Doktor. N. K. Klapp. Modure: 2, föreläsning: 7. MYRSYRA. NPTEL återhämtade sig.Växelström.i
- Jean och Fred. (14 juni 2017). Lämnar högarnas termiter. [Figur]. Återhämtat sig från: Flickr.com

