Sulfonsyrastruktur, nomenklatur, egenskaper, användningar
- 3466
- 815
- Per Eriksson
Det kallas sulfonsyra Vid alla sammansatta tillhör en familj av organiska syror som har en eller flera grupper -så3H. Vissa författare indikerar att farsföreningen är H-S (= O)2-Åh, eller H-så3H, kallad av någon ”sulfonsyra”, har dess existens inte bevisats, och inte heller den för dess ho -s tautomer (= o) -Oh känd som "svavelsyra" (h2Sw3), varken i lösning eller i fast tillstånd.
Det senare beror på att svaveldioxidgas (iv) (så2) I vattenlösning blir det bisulfitjoner (HSO3-) och pyrosulfite (s2ANTINGEN52-) Och inte till H-S (= O)2-OH eller HO -S (= O) -OH, som redan har bevisats av många kemiska forskare.
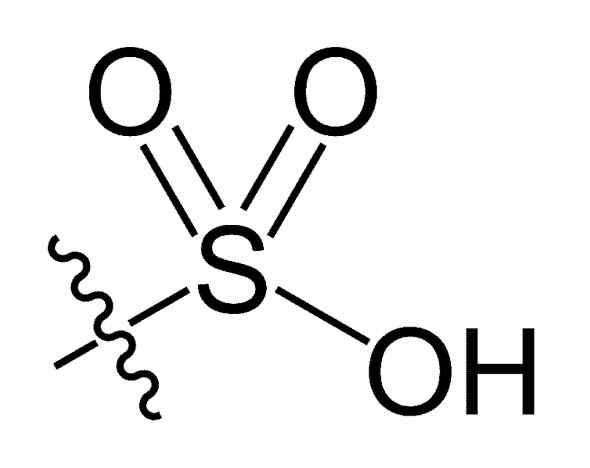
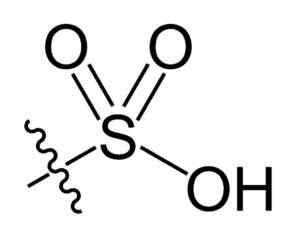 Sulfonilgrupp. Choij [public domain]. Källa: Wikipedia Commons
Sulfonilgrupp. Choij [public domain]. Källa: Wikipedia Commons I den r-så kemiska formeln3H av sulfonsyror, grupp R kan representera kolvätesskelett som alkan, alqueno, alchene och/eller sand. Dessa kan innehålla sekundära funktioner som ester, eter, keton, amino, amido, hydroxyl, karboxyl- och fenolgrupper, bland många andra.
Sulfonsyror är starka syror, jämförbara med svavelsyra (h2Sw4). Resten av sina egenskaper beror emellertid till stor del på gruppens natur.
Vissa har en tendens till desulfonar vid höga temperaturer. Detta innebär att man tappar gruppen -SO3H, särskilt när R är en sandig, det vill säga med bensenring.
Sulfonsyror har många användningsområden beroende på deras kemiska formel. De är vana att tillverka färgämnen, bläck, polymerer, tvättmedel, ytaktiva medel och som katalysatorer, bland många andra tillämpningar.
[TOC]
Strukturera
Sulfonsyror har följande allmänna struktur:
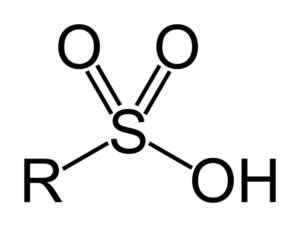 Allmän formel för sulfonsyror. Benjah-Bmm27 [Public Domain]. Källa: Wikipedia Commons
Allmän formel för sulfonsyror. Benjah-Bmm27 [Public Domain]. Källa: Wikipedia Commons Nomenklatur
- Sulfonil Group: -So3H
- Hyrd eller arilsulfonsyra: r-so3H
Egenskaper
De är solida eller vätska beroende på grupp R. Inga gasformiga sulfonsyror är kända.
Dess fysiska och kemiska egenskaper beror på naturen av gruppen r. Som jämförelse finns det några fysiska egenskaper hos flera sulfonsyror, där P.F. Det är smältpunkten och P.och. Det är kokpunkten vid ett tryck på 1 mm Hg:
- Metanosulfonsyra: P.F. 20 ºC; p.och. 122 ºC
- Etanosofonsyra: P.F. -17 ºC; p.och. 123 ºC
- Förslagsyra: P.F. -37 ºC; p.och. 159 ºC
- Butanosulfonsyra: P.F. -15 ºC; p.och. 149 ºC
Kan tjäna dig: järnklorid (fecl2): struktur, användningar, egenskaper- Pentosulfonsyra: P.F. -16 ºC; p.och. 163 ºC
- Hexanosulfonsyra: P.F. 16 ºC; p.och. 174 ºC
- Benzefonsyra: P.F. 44 ºC; p.och. 172 ºC (vid 0,1 mm Hg)
- P-toluensulfonsyra: P.F. 106 ºC; p.och. 182 ºC (vid 0,1 mm Hg)
- 1-naftalensulninsyra: P.F. 78 ºC; p.och. Det sönderdelas
- 2-naftalensulfonsyra: P.F. 91 ºC; p.och. Det sönderdelas
- Trifluormetanosulfonsyra: p.F. ingen; p.och. 162 ºC (vid 760 mm Hg)
De flesta är mycket lösliga i vatten.
Sulfonsyror är ännu fler syror än karboxylsyror. De har surhet som liknar svavelsyra. De löses upp i vattenhaltiga natriumhydroxid och vattenhaltiga bikarbonat.
De tenderar att drabbas. Emellertid är flera av alkosulfonsyrorna termiskt stabila. I synnerhet är trivsyra eller trifluorometansulfonsyra en av de starkaste och mest stabila syrorna.
Erhållande
Arilsulfonsyror
Ailsulfonsyror erhålls vanligtvis genom sulfonationsprocessen som består av att tillsätta ett överskott av röksvavelsyra (h2Sw4 + Sw3) Till den organiska föreningen vill vi ha sulfonar. Till exempel i fallet med bensen:
C6H6 + H2Sw4 C6H5Sw3H + h2ANTINGEN
Arh + H2Sw4 Aros3H + h2ANTINGEN
Sulfonation är en reversibel reaktion, för om vi lägger till bensulfonsyra en utspädd syra och passerar ånga på blandningen3 Och bensen destilleras genom förångning med ånga och förskjuter balansen mot desulfonation.
Sulfonantmedlet kan också vara klorosulfurinsyra, sulfaminsyra eller sulfitjoner.
Alkylofonsyror
Dessa framställs vanligtvis genom sulfo-oxidation, det vill säga behandling av alkylföreningar med svaveldioxid så2 och syre eller2, eller direkt med svaveltrioxid så3.
Rh + 2so2 + ANTINGEN2 + H2Eller R-så3H + h2Sw4
Ansökningar
Sulfonsyror för ytaktiva medel och tvättmedel
Alkybenfinsyror används vid tillverkning av tvättmedel, är en av de mest utbredda användningarna.
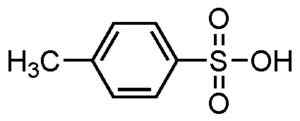 P-metylbenzefonsyra. Su-no-g. Källa = självgjorda. *Datum = 21 aug 2006. *Gjord med Chemdraw. Källa: Wikipedia Commons.
P-metylbenzefonsyra. Su-no-g. Källa = självgjorda. *Datum = 21 aug 2006. *Gjord med Chemdraw. Källa: Wikipedia Commons. De används för pulveriserade och flytande tvättmedel, tvättmedel för tunga eller lätta uppgifter, händer och schampo tvålar.
De aktiva komponenterna är i allmänhet den alkybensen linjära och sulfonerade feta estrarna.
Eftersom ytaktiva ämnen är vanliga alfa-olefinsulfonater, disulfonater, disulaterar sulfosuccinater och hyrda Étere diffeniliska, som alla härstammar från sulfonsyror.
Kan tjäna dig: natriumoxalat (Na2C2O4): struktur, egenskaper, användningar, riskerDessa ytaktiva ämnen finner användning i hushållens rengöringsprodukter, kosmetika, polymerisation i emulsioner och kemisk tillverkning för jordbruk.
Ligosulfonaterna härleds sulfonerade från lignin, en komponent av trä, och används som spridande, fuktgivande, bindande medel i vägbeläggningar, betongtillsatser och tillsatser i djurmat.
En 2-naftalanosulfonsyra härledd används för att öka cementfluiditeten och styrkan.
Sulfonsyrabaserad färg
Dessa kännetecknas vanligtvis av att innehålla Azo-grupper (R-N = N-R).
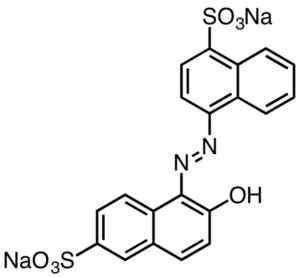 Syrad färg. Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons.
Syrad färg. Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]. Källa: Wikipedia Commons. Sulfonsyra -härledda färgämnen har användbarhet i pappersindustrin, bläck som injektionstryck, textilier som bomull och ull, kosmetika, tvålar, tvättmedel, mat och läder.
Ett 2-naftalanosulfonsyrarivat används också som färgingrediens för polyesterfibrer och läderbrunning.
Amider baserade på sulfonsyror
Denna applikation belyser akrylamidefonsyrorna, som har polymerer att använda, i metallelektrod, såsom ytaktiva medel och i transparenta antikompanionsbeläggningar.
De används också i förbättrad oljeåtervinning, som sammansatta -spärrade medel på jord, i hydrauliska cementblandningar och som aminoplastiska hartser härdar acceleratorer.
Vissa sulfonamider används också i insektsmedelformler.
Fluorerade och klorfluor sulfonsyror
Denna grupp belyser trifluormetanosulfonsyra (CF3Sw3H), även kallad trifiksyra. Denna förening har en organisk syntes- och polymerisationsreaktioner katalys.
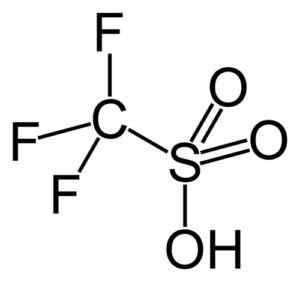 Trifsyra. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons.
Trifsyra. Capacio [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Källa: Wikipedia Commons. Till exempel används den vid polymerisation av aromatiska olefiner och vid beredningen av mycket grenade paraffiniska kolväten med ett högt oktannummer för att använda dem som bränsleadditiver.
En annan av dess tillämpningar ligger i syntesen av ledande polymerer, med hjälp av polyacetylendoping, till exempel typ, typ halvledare p.
Pentafluoroetanosulfonsyra (CF3Jfr2Sw3H), känd som pentaplinsyra, används som organisk katalysator.
Trific syra reagerar med antimon pentafluorid (SBF5) Generera den så kallade "Magic Acid", en supersyrakatalysator som tjänar för alkylering och polymerisation.
Kan tjäna dig: Jodtinktur: egenskaper, användningar, kontraindikationerNafion-H är ett jonbytesharts av en parfymerad polymersulfonsyra. Det har kännetecknet att vara inert mot starka syror, starka baser och reducera eller oxidera medel.
I biologiska tillämpningar
En av de få sulfonsyrorna som finns i naturen är 2-aminoethanosulfonsyra, bättre känd som tjurfäktning, en väsentligen aminosyra, särskilt för katter.
Syntetisk och naturlig tjurfäktning används som tillskott i husdjurs- och läkemedelsprodukter.
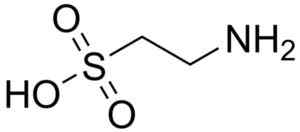 Tjurfäktningsmolekyl. Harbinär. Källa: Wikipedia Commons
Tjurfäktningsmolekyl. Harbinär. Källa: Wikipedia Commons Taurokolsyra är en gallkomponent och deltar i matsmältningen av fetter. 8-Anilino-1-naftalanosulfonsyra, en syntetisk förening, används i studien av proteiner.
Urea -sampolymerer och bifenyldisulfonsyra har använts som herpes simplexvirusinhibitorer.
Vissa sulfonsyraderivat, såsom sulfonerad polystyren och vissa azocompiestos, har visat hämningsegenskaper hos humant immunbrist eller HIV -virus, utan att vara alltför giftigt mot värdceller.
I oljeindustrin
Vissa blandningar av oljederivat, som inkluderar en varierad kombination av aromatiska, paraffiner och polynukleära aromatiska, kan sulfoneras och sedan korrekt neutraliseras generering av de så kallade oljesulfonaterna.
Dessa oljesulfonater har egenskapen att sänka operationen i vatten. Dessutom är produktionen mycket låg kostnad.
Av denna anledning injiceras oljesulfonater i befintliga oljebrunnar som hjälper återhämtningen av råolja som är tilltäppt mellan stenar under ytan.
I formuleringen av smörjmedel och antikorrosiv
Magnesiumsulfonater har vid användning i smörjmedelformler såsom spridningsdetergenttillsatser och för att undvika slitage.
Bariumsulfonater används i anti -flint -smörjmedel för användningar som används i höghastighetsapplikationer. Natrium- och kalciumsulfonater har smörjmedel och fettfetter för att förbättra extrema tryckegenskaper.
Sulfonsyramagnesiumsalter är också användbara i antikorrosiva applikationer som beläggningar, fetter och hartser.
Referenser
- Falk, Michael och Giguere, Paul a. (1958). På svavelsyra. Canadian Journal of Chemistry, Vol. 36, 1958. Återhämtat sig från nrcresearchpress.com
- Betts, r.H. och Voss, r.H. (1970). Kinetiken för syreutbyte mellan sulfitjon och vatten. Canadian Journal of Chemistry, Vol. 48, 1970. Återhämtat sig från nrcresearchpress.com
- Bomull, f.TILL. Och Wilkinson, G. (1980). Avancerad oorganisk kemi. Fjärde upplagan. Kapitel 16. John Wiley & Sons.
- Kirk-THERMER (1994). Encyclopedia of Chemical Technology. Volym 23. Fjärde upplagan. John Wiley & Sons.
- Kosswig, Kurt. (2012). Ytaktiva medel. Ullmanns Encyclopedia of Industrial Chemistry Vol. 35. Wiley-VCH Verlag GmbH & Co.
- « Klordioxid (CLO2) struktur, användning, erhållning, risker, egenskaper
- Polyaktinsyrastruktur, egenskaper, syntes, användningar »

