Syror och basskillnader, egenskaper, exempel
- 1970
- 284
- PhD. Lennart Johansson
De syror och baser De är kemiska föreningar som inte presenterar en enda definition, men flera, som beror på egenskaperna eller egenskaperna som beaktas. I allmänna termer kan det sägas att syror är sura ämnen, medan baserna är saponáceas eller tvålar.
De viktigaste definitionerna, som Brönsted-Lowry, eller Arrhenius, fokuserar mer på frisläppandet av hjoner3ANTINGEN+ (Hydronium) u oh-(hydroxyl) av dessa ämnen. Antingen i sina rena eller upplösta former i vatten.
En definition som uppstår som en följd av ovanstående är följande: Syror upplösta i vatten genererar lösningar med pH -värden mindre än 7, medan upplösta baser producerar lösningar med pH -värden större än 7. PH är just ett sätt att uttrycka hur surt eller grundläggande är en vätska som tar hänsyn till koncentrationen av H3ANTINGEN+.
Därför har sura ämnen, såsom apelsinjuice, ett pH mindre än 7 och många hjoner3ANTINGEN+. Medan baserna, såsom Legía, har ett pH större än 7 och många OH -joner-.
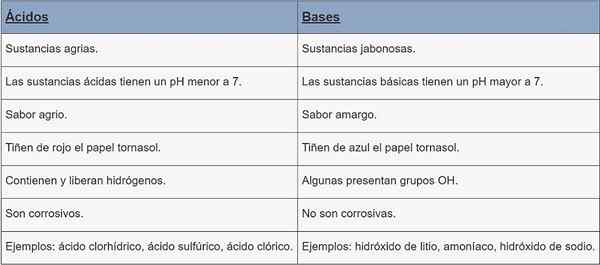
Syror | Baser | |
Typ av substans | Jordbrukare. | Jabonesas ämnen. |
pH | pH mindre än 7. | pH större än 7. |
Smak | Sur. | Bitter. |
Utformning | Rött vattendrag. | Cornstasol Paper Dye Blue. |
Egenskaper | De innehåller och släpper hydrogener. | Några nuvarande OH -grupper. |
Korrosion | De är frätande. | De är inte frätande. |
Exempel | Saltsyra, svavelsyra, klorsyra. | Litiumhydroxid, ammoniak, natriumhydroxid. |
Syror
 Apelsinjuice är en av de mest kända syrrepresentanterna för våra dagliga liv
Apelsinjuice är en av de mest kända syrrepresentanterna för våra dagliga liv Syraegenskaper
Syra ämnen har vissa egenskaper:
Sur smak
Syror har en sur smak. Rutinmässigt betecknas en typ av smak med termen "syra". Således sägs det att citronsaften och vätskan hos vissa gummi är syror, eftersom dess smaker är sura och starka för gommen.
Rött vattendrag
Syror är ämnen som kan vrida färgen på det blå till rött spraypapper. Shortasol är en del av en uppsättning ämnen som kan ändra färg beroende på graden av surhet eller basicitet i miljön där de finns. Dessa ämnen kallas pH -indikatorer.
Kan tjäna dig: Coligative Egenskaper hos lösningarDe innehåller och släpper hydrogener
Syrorna är kemiska föreningar som har det vätekemiska elementet (H), vilket ger det dess surhetsegenskaper.
Många andra ämnen innehåller också väte, men de kan inte släppa det eftersom det händer med syror. Vid befriande är väte i form av jon eller cation+. Dessa h+, När de möter vattenmolekylerna läggs de till dessa för att bilda hjonerna3ANTINGEN+.
De transporterar elektrisk ström
På grund av H -atomer+ som släpps när syror i vatten löses, dessa kan transportera elektricitet genom användning av batterier eller batterier.
De är frätande
Det finns starka syror som är mycket frätande. Därför bör kontakt med dem undvikas, eftersom de kan orsaka allvarliga fysiska skador. Till och med svaga syror, vid mycket höga koncentrationer, såsom ättik (vinäger) kan bränna huden och svelget om deras ångor andas.
Stark och svag
Starka syror ger en stor koncentration av hjoner3ANTINGEN+ När de löses upp i vattnet. Det sägs att väteatomerna hos starka syror lätt är dissocierade. Samtidigt frigör svaga syror få väteatomer och producerar därför en lägre koncentration av hjoner3ANTINGEN+.
Starka syror har ett mycket lågt pH, vilket beroende på syraens koncentration och kraft kan vara 1 eller mindre. Istället har svaga syror ett högre surt pH, vilket kan vara till exempel 4 eller 5.
Starka syror har en lukt som ger en brinnande känsla. Samtidigt presenterar svaga syror inte denna typ av lukt, även i vissa fall har de trevliga luktar. Det finns dock många undantag, så de rekommenderas inte att lukta ens svaga syror.
Kan tjäna dig: järnoxid (iii): struktur, nomenklatur, egenskaper, användningarStarka syror är bra eltransportörer. Tvärtom, svaga syror är dåliga elektricitetsledare genom att släppa några H -atomer+.
Starka syror kan attackera metaller, såsom zink, som bildar ett stort antal vätebubblor. Denna reaktion produceras inte av svaga syror.
Exempel på syror
Starka syror
-HCl: saltsyra
-H2Sw4: svavelsyra
-HBR: Bromhydric Acid
-Hej: Yodhydrric Acid
-Hno3: salpetersyra
-Hclo4: Perklorsyra
-Hclo3: Klorsyra
Svaga syror
-Ch3COOH: ättiksyra
-Hno2: Kvävesyra
-H2Co3: Kolsyra
-H3Po4: fosforsyra
-C3H5O (COOH): citronsyra
-HF: fluorhydronsyra
-H2Sw3: Svavelsyra
Baser
 Ammoniaken är ett grundläggande ämne
Ammoniaken är ett grundläggande ämne Basegenskaper
Baserna presenterar följande egenskaper:
-De producerar en viskös eller tvålsensation i fingrarna, vilket gör att föremålen tas av händerna att bli hala.
-De har en bitter smak.
-De kan reagera med syror och producera bildningen av föreningar som kallas salter. I vissa fall kan dessa fälla ut eller sjunka ner i vattnet. I reaktionen av en bas med en syra bildas också vatten.
-De vänder färgen på det blå groddpapperet, vilket indikerar att lösningen har ett pH större än 7 eller alkaliskt.
-Vissa baser finns i deras kemiska formel OH -grupper, kallad hydroxilli, som bildas av en väteatom och en syreatom.
Stark och svag
Starka baser är kemiska föreningar som presenterar en eller flera OH -grupper i sin kemiska struktur, som när de kommer i kontakt med vatten får en negativ belastning, OH-.
Samtidigt finns de svaga baserna inte i sina kemiska formelhydroxilsgrupper. Men svaga baser när man reagerar med vatten producerar också joner eller anjoner åh-.
Starka baser, såsom natriumhydroxid, har mycket höga pH -värden, nära 14. Samtidigt har svaga baser lägre pH, såsom ammoniak, som har ett pH på 11.
Kan tjäna dig: kokning: koncept, typer och exempelStarka baser används i hem för att avslöja avloppet. Så är fallet med kaliumhydroxid. Samtidigt används svaga baser vid rengöringsarbete, till exempel ammoniak som finns i många städare.
Exempel på baser
Starka baser
-LIOH: litiumhydroxid
-NaOH: natriumhydroxid
-KOH: Kaliumhydroxid
-RBOH: Rubidio Hydroxide
-CSOH: Cesiumhydroxid
-SR (OH)2: Strontiumhydroxid
-BA (OH)2: bariumhydroxid
Svaga baser
-Nh3: ammoniak
-Nhet2: dietylamin
-Nh2Ch3: Metilamin
-C5H5N: pyridin
Skillnader mellan syror och baser
Joner som släpps ut
Syror släpper Hatomer+ eller h3ANTINGEN+ När de löses upp i vattnet. Under tiden släpper eller producerar baserna i kontakt med vattenjoner OH-.
PH -värden
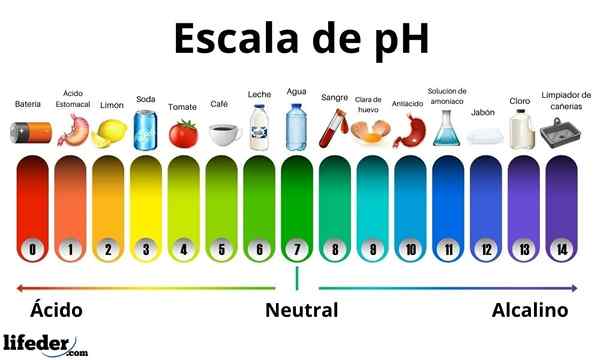
Syror har ett pH -värde mellan 0 och 7. Under tiden har baserna ett pH -värde mellan 7 och 14. Därför vänder syrorna färgen på groddpapperet och baserna blir det i blått.
Träningsreaktioner
Syror härstammar från reaktionen av icke -metalliska elementoxider, till exempel klor, svavel, etc., Med vatten, eller så bildas de också när väte kombineras med ett icke -metalliskt element och sedan upplöses den bildade föreningen i vatten (HF, HCL, HBR, etc.).
Baserna produceras genom oxidreaktionen av en metall, till exempel järn, koppar, magnesium, etc., Med vatten. Det bör komma ihåg att en oxid är kombinationen av syreatomer med något annat kemiskt element.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (11 februari 2020). Syradefinition och exempel. Återhämtat sig från: tankco.com
- Vetenskapsutforskare. (31 juli 2018). Lära barn om syror och baser. Återhämtat sig från: scienceexplorer.com
- Utarbetande exemplar. (2013). Syraegenskaper. Återhämtad från: exemplary.com
- Lumenkemi för icke-major. (s.F.). Egenskaper hos syror och baser. Återhämtat sig från: kurser.Lumenarning.com
- Clark Jim. (2013). Starka och svaga baser. Återhämtat sig från: Chemguide.co.Storbritannien
- « Flora och fauna från den ecuadorianska Sierra -representanten
- Metodologiska ramar hur man skriver det, struktur, exempel »

