Tennklorid (II)
- 2007
- 324
- PhD. Emil Svensson
han Tennklorid (Ii) eller liten klorid, av den kemiska formeln SNCL2, Det är en vit och kristallin fast förening, produkt av tennreaktionen och en koncentrerad saltsyralösning: SN (S) + 2HCl (conc) => SNC2(aq) + h2(g). Processen för dess syntes (beredning) består i att lägga till tennstycken för att reagera med syra.
Efter tillsats av tennstycken utförs uttorkning och kristallisation tills det oorganiska saltet erhålls. I denna förening har tennet tappat två elektroner i sitt valensskikt för att bilda kopplingar till kloratomer.
Detta kan förstås bättre om Tin Valencia -konfigurationen övervägs (5s25 px2poch0pz0), varav paret av elektroner som upptar orbitalen px tilldelas protonerna h+, För att bilda en diatomisk vätemolekyl. Det vill säga detta är en redox -reaktion.
[TOC]
Tennkloridegenskaper
 Tennklorid (ii) dihydrat
Tennklorid (ii) dihydrat SNCL -länkar2 De är joniska eller kovalenta typ? De fysikaliska egenskaperna hos tennklorid (ii) Kassera det första alternativet. Fusions- och kokpunkterna för denna förening är 247 ºC och 623 ºC, vilket indikerar svaga intermolekylära interaktioner, vanligt faktum för kovalenta föreningar.
Hans kristaller är vita, vilket innebär nollabsorption i det synliga spektrumet.
Valencia -konfiguration
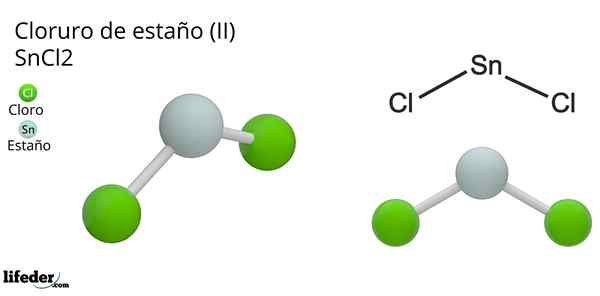
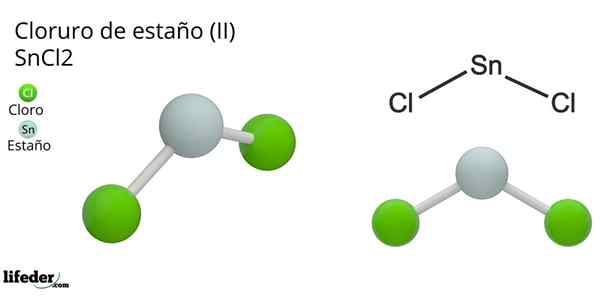
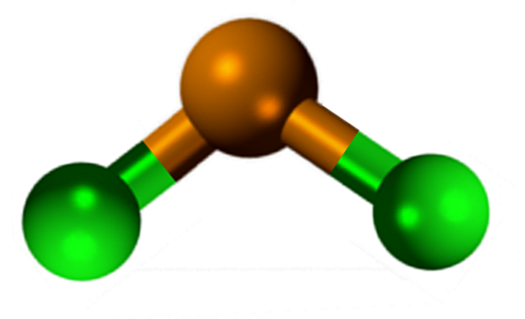
På bilden ovan illustreras en isolerad mynta av Snick2.
Molekylär geometri ska vara platt eftersom hybridiseringen av den centrala atomen är SP2 (3 sp orbitaler2 och en ren p -orbital för att bilda kovalenta bindningar), men elektronfritt vridmoment upptar volymen och skjuter kloratomerna ner, vilket ger molekylen en vinkelgeometri.
I gasfasen är denna förening isolerad, så den interagerar inte med de andra molekylerna.
Kan tjäna dig: förtvålningSom förlust av paret av elektroner i omloppet px, Tenn förvandlas till SN -jonen2+ och dess resulterande elektroniska konfiguration är 5s25 px0poch0pz0, Med alla dess orbitaler tillgängliga för att acceptera länkar från andra arter.
Cl -joner- De samordnar med SN -jonen2+ Att ge upphov till tennklorid. Elektronisk tennkonfiguration i detta salt är 5s25 px2poch2pz0, Att kunna acceptera ett annat par elektroner i din gratis orbital pz.
Till exempel kan du acceptera en annan jon cl-, bildar det trigonala platta geometri -komplexet (en triangulär baspyramid) och negativt laddad [SNCL3]-.
Reaktivitet
SNCL2 Den har hög reaktivitet och trend att bete sig som Lewis Acid (Electron Receptor) för att slutföra sin Valencia Octet.
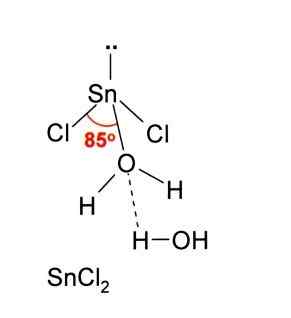
Samt acceptera en jon cl-, Detsamma gäller för vatten, som "hydratiserar" tennatomen när en vattenmolekyl är kopplad direkt till tennet, och en andra vattenmolekyl bildar interaktioner med vätebroar med den första.
Resultatet av detta är att SNCL2 Det är inte rent, men koordinerat med vattnet i dess dihydratiserade salt: SNCL2· 2h2ANTINGEN.
SNCL2 Det är mycket lösligt i vatten- och polära lösningsmedel, eftersom det är en polär förening. Emellertid aktiverar dess löslighet i vatten, mindre än dess massvikt, en hydrolysreaktion (brott av en vattenmolekyl) för att generera ett grundläggande och olösligt salt:
SNCL2(aq) + h2Eller (l) sn (OH) cl (s) + hcl (aq)
Dubbelpilen indikerar att en balans är etablerad, gynnad till vänster (mot reagensen) om HCL -koncentrationerna ökar. Därför SNCL -lösningar2 Anställda har ett surt pH för att undvika nederbörd av oönskad saltprodukt av hydrolys.
Det kan tjäna dig: nukleofil: nukleofil attack, typer, exempel, nukleofilicitetReduktiv
Reagerar med syre i luften för att bilda tennklorid (IV) eller klorid är:
6 SNCL2(aq) + o2(g) + 2h2Eller (l) => 2sncl4(aq) + 4sn (OH) cl (s)
I denna reaktion oxiderar tennens formningslänk till den elektronegativa syreatomen och ökar antalet bindningar med kloratomer.
I allmänhet stabiliserar de elektronegativa atomerna i halogener (F, CL, BR och I) länkarna för SN (iv) föreningar och detta faktum förklarar varför SNCL2 är ett reducerande medel.
När de oxideras och förlorar alla sina valenselektroner, snjonen4+ är 5s -konfiguration05 px0poch0pz0, Att vara paret av elektroner i 5S -omloppet är det svåraste att "tas bort".
Kemisk struktur av tennklorid
 Tennkloridstruktur (II)
Tennkloridstruktur (II) SNCL2 Den presenterar en kristallin struktur av ortorrombisk typ, liknande serruchos -rader, där tändernas spetsar är klorider.
Varje rad är en SNCL -kedja3 bildar en CL-bro med en annan SN-atom (CL-SN (CL)2-Cl- ···). Två kedjor, tillsammans med svaga interaktioner mellan SN-CL-typen utgör ett lager av arrangemanget, som överlappar ett annat lager, och så vidare tills det definierar det kristallina fasta ämnet.
Det fria elektronparet 5S2 Orsaka snedvridning i strukturen eftersom den upptar volymen (volymen på det elektroniska molnet).
SN kan ha ett koordinationsnummer lika med nio, vilket är detsamma som att ha nio grannar, dra ett trigonalt prisma med detta beläget i mitten av den geometriska figuren och CL i vertikterna, utöver andra CL som ligger i var och en av Prisens fyrkantiga ansikten.
Kan tjäna dig: hydraceDetta är lättare att observera om det betraktas som en kedja där SN (mörkgrå sfärer) pekar upp, och de tre cl kopplade till denna form det triangulära golvet, medan de tre klienterna bildar det övre triangulära taket.
Användning/applikationer
I organisk syntes används det som ett reducerande medel för aromatiska nitroföreningar (AR-NO2 à ar-nh2). Eftersom dess kemiska struktur är laminär finner den användning i världen av organiska reaktioner katalys, förutom att vara en potentiell kandidat för katalytiskt stöd.
Dess reducerande egenskap utnyttjas för att bestämma närvaron av guldföreningar, för att täcka glas med silverspeglar och för att tjäna som antioxidant.
I sin molekylära geometri trigonal pyramid (: SNX3- M+) används som en Lewis -bas för syntes av ett stort antal föreningar (såsom PT -klusterkomplexet3Sn8Klitjugo, där elektronfritt par är koordinerat med en Lewis -syra).
Risker
SNCL2 Du kan skada vita blodkroppar. Det är frätande, irriterande, cancerframkallande och har höga negativa effekter på de arter som bor i marina ekosystem.
Kan sönderdelas vid höga temperaturer och släppa den skadliga klorgasen. I kontakt med mycket oxiderande medel utlöser explosiva reaktioner.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. I Elementen i grupp 14 (fjärde upplagan., p. 329). MC Graw Hill.
- Kemikaliebok. (2017). Chemicalbook: Chemicalbook.com
- Pub. (2018). Tennklorid. Pubchem återhämtat sig: Pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2017). Tenn (ii) klorid. Wikipedia återhämtade sig: i.Wikipedia.org
- F. Skenare. (1976). Strukturell kemi för lager av skikttyp. P-20,121. D. Reidel Publishing Company.

