Kvicksilverklorid (II) Struktur, egenskaper, erhållning, användning

- 4552
- 724
- Per Karlsson
han Kvicksilverklorid (II) Det är en oorganisk förening bildad av en atom av metallkvicksilver (Hg) och två atomer av klorhalogen (CL). Kvicksilver är i sitt +2 oxidationstillstånd och klor -1.
Dess kemiska formel är HGCL2. Det är ett något flyktigt kristallint fast vid rumstemperatur. Fackföreningar bland sina atomer är mer kovalenta än joniska.
 Kvicksilverklorid (II). MRGREEN71/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons.
Kvicksilverklorid (II). MRGREEN71/CC BY-SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0). Källa: Wikimedia Commons. När den löses i vatten upprätthåller den sin molekylstruktur. Det är också lösligt i flera organiska lösningsmedel. Med ljus av ljus tenderar det att bilda metallkvicksilver.
Tidigare användes det som ett antiseptiskt medel och för att behandla vissa infektionssjukdomar, både hos människor och djur. Också som insektsmedel för att kontrollera skadedjur som myror och termiter.
Men när deras höga toxicitet verifieras övergavs de flesta av dessa användningar och används för närvarande endast i kemi eller biokemiska analyslaboratorier.
Kan utnyttja under vissa förhållanden. Det är en giftig förening, det orsakar skada på människor, djur och växter. Det ska aldrig kasseras i miljön. Det misstänks också för att vara cancerframkallande.
[TOC]
Strukturera
Kvicksilverklorid består av Hg i oxidation II och klor med Valencia -1. I denna haluro har länkarna mellan atomerna en mycket markant kovalent karaktär.
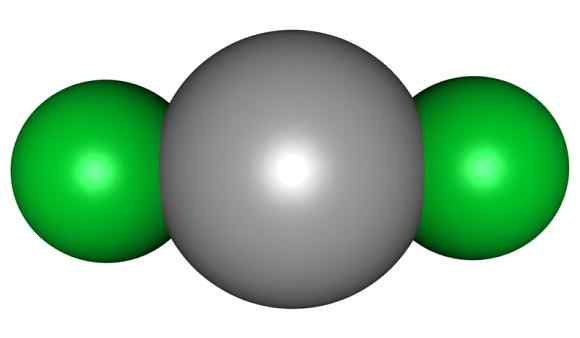 HGCL -molekyl2. Grå = kvicksilver; Grön = klor. Arrowsmaster / Public Domain. Källa: Wikimedia Commons.
HGCL -molekyl2. Grå = kvicksilver; Grön = klor. Arrowsmaster / Public Domain. Källa: Wikimedia Commons. Detta innebär att i glaset bibehåller föreningen sin molekylstruktur CL-HG-CL där Hg-Cl-avståndet liknar när det är i ett gasformigt tillstånd, medan i glaset är avståndet med kloratomerna i andra molekyler mycket är mycket äldre.
 HGCL -molekyler2 I glaset. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons.
HGCL -molekyler2 I glaset. Benjah-Bmm27 / allmän domän. Källa: Wikimedia Commons. I gasformigt tillstånd är det tydligt molekylt och även i vattenlösning.
Nomenklatur
- Kvicksilverklorid (II)
- Kvicksilverklorid
- Kvicksilverbiklorid
- Dicloromercurio
Egenskaper
Fysiskt tillstånd
Vit kristallint fasta, Rombic Crystals.
 Fast kvicksilverklorid. Leiem/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons.
Fast kvicksilverklorid. Leiem/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0). Källa: Wikimedia Commons. Molekylvikt
271,5 g/mol
Smältpunkt
280 ºC
Sublimeringspunkt
Vid 300 ° C sublima, det vill säga det går direkt från gas fast.
Densitet
5,6 g/cm3
Löslighet
Lite vattenlösligt: 7,31 g/100 ml vid 25 ° C. Alkohollöslig: 33 g/ 100 ml vid 25 ° C. Etylacetatlöslig. Little Loluble in Ether: 4 g/100 ml. Något lösligt i bensen.
Det kan tjäna dig: Helmholtz Free Energy: Enheter, hur det beräknas, lösta övningarpH
En lösning av 0,2 mol/L har ett pH av 3,2-4,7.
Kemiska egenskaper
I vattenlösning finns det nästan uteslutande (∼ 99%) i form av en HGCL -molekyl2. Det lider dock lite hydrolys:
Hgcl2 + H2Eller ⇔ hg (OH) Cl + H+ + Kli-
Hgcl2 + 2 h2Eller ⇔ hg (oh)2 + 2 h+ + 2 Cl-,
Det presenterar en markant löslighet i organiska lösningsmedel, där det tar form av dimerer, det vill säga två bundna molekyler.
I närvaro av organiskt material och genom solljus reduceras det att bilda kvicksilverklorid (I) (HGCL) och sedan metallisk kvicksilver.
Hgcl2 + Solljus → HGCL → HG0
Med natriumhydroxidlösning (NaOH) genererar en gul preurumgul fällning (HGO).
Det är oförenligt eller reagerar med former, sulfiter, fosfater, sulfider, gelatin, albumin, alkalis, ammoniak, kalciumhydroxid, bromider, karbonater, järn, koppar, bly, silversalter och vissa växtmaterial.
Andra egenskaper
Bland annat på grund av dess mest kovalenta än joniska karaktär är den något flyktig vid rumstemperatur och den är märkbart förångad vid 100 ° C.
Erhållande
Du kan förbereda oxiderande metallkvicksilver (HG0) med klorgas (CL2). Vid uppvärmning och når mer än 300 ° C visas en låga och en ånga som samlas in sublimeras och när HGCL -kristallerna bildas2.
Hg + cl2 + Värme → HGCL2
Det erhålls också genom att värma kvicksilver sulfat (ii) torrt med natriumklorid. HGCL -ångor2 att subliman samlas in och kondenseras till ett kristallint fast ämne.
Hgso4 + 2 NaCl → HGCL2 + Na2Sw4
Reaktionen mellan kvicksilveroxid (ii) med saltsyra i stökiometriska mängder producerar HGCL -kristaller2 När mediet kyls.
Hgo + 2 HCl → Hgcl2 + H2ANTINGEN
Kristaller kan renas genom omkristallisation och sublimering.
Ansökningar
I kemiska laboratorier
Det används som ett reagens i olika kemiska analyser. Det tillåter framställning av andra kvicksilverföreningar, såsom kvicksilverjodid (II), kvicksilveroxid (II), kvicksilverklorid (I), ammonium och kvicksilverklorid (II).
Kan tjäna dig: fluorid: historia, egenskaper, struktur, erhållning, risker, användningarI patologilaboratorier
Det är en del av den ättikliga lösningen av Zenker, som används för att behandla prover eller prover av benmärgsbiopsier. Vävnaderna ställs snabbt in med utmärkta histologiska detaljer som ska observeras med mikroskopet.
 Ibland hgcl2 Det används i patologilaboratorier. Författare: Ernesto Eslava. Källa: Pixabay.
Ibland hgcl2 Det används i patologilaboratorier. Författare: Ernesto Eslava. Källa: Pixabay. Övergivna användningar
Under medeltiden och fram till början av XX användes den i olika tillämpningar, eftersom dess skadliga effekt för hälsa var okänd.
- Som behandling av vissa sjukdomar, topiska antiseptiska och desinfektionsmedel.
 Tidigare HGCL2 Det användes för att behandla syfilis. G. H. Räv / allmän domän. Källa: Wikimedia Commons.
Tidigare HGCL2 Det användes för att behandla syfilis. G. H. Räv / allmän domän. Källa: Wikimedia Commons. - I veterinärmedicin som ett kaustiskt, desinfektionsmedel och antiseptiskt medel.
- I jordbruket agerade han som en fungicid, för att kontrollera landmaskar, såsom insektsmedel och avvisande av kackerlackor, myror och termiter, och som ett desinfektionsmedel för att skydda frön och glödlampor.
- För träbevarande, kemiskt medel för att balsamera och bevara anatomiska prover.
- Som en katalysator för att erhålla vinylklorid från acetylen.
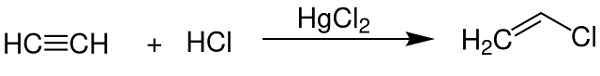 Kvicksilverklorid (II) fungerar som en katalysator för att erhålla vissa kemiska föreningar. Chem Sim 2001 / Public Domain. Källa: Wikimedia Commons.
Kvicksilverklorid (II) fungerar som en katalysator för att erhålla vissa kemiska föreningar. Chem Sim 2001 / Public Domain. Källa: Wikimedia Commons. - I aluminiumelektrod.
- Att markera järn och stål.
- Som fotograferingsreagens.
- I tyger trycker du, som en mordant för kanin och ricinpäls, för träfärgämne.
- Som en del av torkade batterier.
Risker
För hälsan
Det är en frätande och extremt giftig förening om den intas, eftersom det kan orsaka dödsfall. Attackerar gastrointestinala kanaler och njursystemet. Orsaka svåra brännskador på huden och ögonen.
Långvarig eller upprepad exponering för denna förening orsakar skador på inre organ. Alla former av kvicksilver är giftiga och HGCL2 är en av de mest giftiga.
Det misstänks att det är cancerframkallande, vilket orsakar genetiska defekter och skador på fertilitet.
Brandfara
Även om det inte är bränsle kan explodera när man applicerar värme. När det bryter ner toxiska och kvicksilver toxiska gaser.
HGCL -blandningar2 Med alkaliska metaller som natrium eller kalium är de mycket känsliga för slag och kan utnyttja effekterna. Om du kommer i kontakt med ammoniak kan sulfider, oxalsyra och acetylen också explodera.
Kan tjäna dig: saltsyra (HCl)Effekter på miljön
Det är mycket giftigt för vatten- och landorganismer, dess effekter varar med tiden. Det kan presentera bioackumulering i hela livsmedelskedjan, både i växter och djur.
 Mercuric -klorid ska aldrig kasseras i miljön. Författare: Naadjuuh. Källa: Wikimedia Commons.
Mercuric -klorid ska aldrig kasseras i miljön. Författare: Naadjuuh. Källa: Wikimedia Commons. Det påverkar andning, fotosyntes och andra metaboliska vägar för växter som orsakar deras försämring. Dess disposition i miljön (varken vatten eller jord eller atmosfär) bör inte påverkas).
Farlig närvaro i vissa naturliga botemedel
Trots dess toxicitet finns det naturliga läkemedel och örter som innehåller det, så människor utan att veta det är farligt utsatta för denna förening.
Till exempel i traditionell kinesisk medicin innehåller Calomel eller Qing Fen några HGCL2. Det är ett botemedel som används som diuretiska, antiseptiska, hudsalva, laxerande och appliceras externt för tandläkare hos barn.
 Vissa FN -kontrollerade naturliga läkemedel kan innehålla HGCL2. Författare: Silvija varelser. Källa: Pixabay.
Vissa FN -kontrollerade naturliga läkemedel kan innehålla HGCL2. Författare: Silvija varelser. Källa: Pixabay. Referenser
- ELLER.S. National Library of Medicine. (2019). Kvicksilverklorid. Återhämtat sig från pubchem.Ncbi.Nlm.Nih.Gov.
- Lester, s.C. (2010). Provbehandling. Zenkers Acetic Fixative (Orange). I Manual of Surgical Pathology (tredje upplagan). Återhämtat sig från Scientedirect.com.
- Clarksson, T.W. (2001). Agenter. Fysiska och kemiska egenskaper. I Handbook of Peticid Toxicology (andra upplagan). Återhämtat sig från Scientedirect.com.
- Fretham, s.J.B. et al. (2015). Kvicksilver och neurodegeneration. Naturliga läkemedel och örter som innehåller Hg. I bioaktiva nutraceuticals och kosttillskott vid neurogisk och hjärtsjukdom. Återhämtat sig från Scientedirect.com.
- Riddare. et al. (2014). Distribution och överflöd av vattenväxter - mänskliga effekter. Kemisk polutanter. I referensmodulering i jordsystem och miljövetenskap. Återhämtat sig från Scientedirect.com.
- Bly, D.R. (redaktör) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Bomull, f. Albert och Wilkinson, Geoffrey. (1980). Avancerad oorganisk kemi. Fjärde upplagan. John Wiley & Sons.
- Ciavatta, l. och Grimaldi, m. (1968). Hydrolysen av kvicksilver (ii) klorid, HGCL2. Journal of Inorganic and Nuclear Chemistry, Volym 30, nummer 2, februari 1968, sidorna 563-581. Återhämtat sig från Scientedirect.com.
- Wikimedia Foundation (2020). Kvicksilver (ii) klorid. Hämtas från.Wikipedia.org.
- « 21 mexikanska forskare och deras historiska bidrag
- Mercury Fulminate Structure, Egenskaper, erhållning, användningar »

