Kemisk förening
- 2889
- 625
- Erik Eriksson
Vi förklarar vilka kemiska föreningar består av, de typer som finns, skillnaderna med de kemiska elementen och ger flera exempel.
 Kemiska föreningar är allt det ämnet som har atomer i två olika kemiska element
Kemiska föreningar är allt det ämnet som har atomer i två olika kemiska element Vad är en kemisk förening?
En kemisk förening Det är ett ämne som bildas av föreningen mellan två eller flera atomer av olika kemiska element. De kemiska föreningarna förblir förenade tack vare de kemiska bindningarna, som är relaterade till elektronerna i de länkade atomerna; Det vill säga, i en kemisk förening ingriper de (yttersta) elektronerna i atomerna i länkarnas bildning.
Komponenterna i kemiska föreningar (kemiska element) kan inte separeras från varandra med fysiska metoder, såsom: destillation, centrifugering, filtrering, etc., kräver kemiska metoder för att uppnå det.
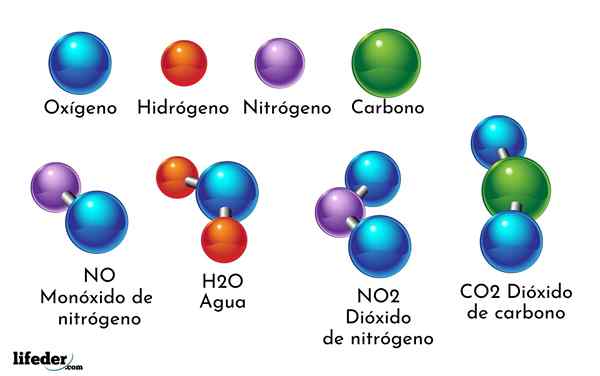
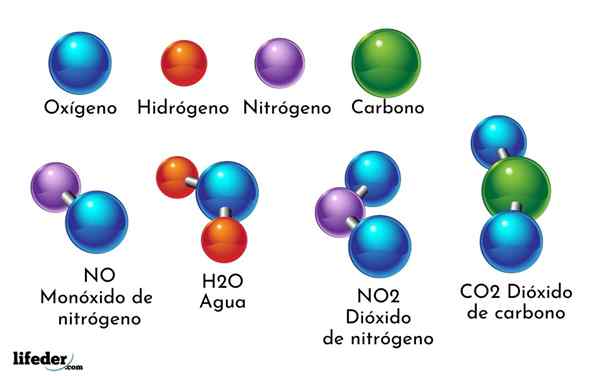
Ett exempel på kemisk förening är vatten. Det bildas av endast två atomer av två olika kemiska element: syre och väte, med den kemiska formeln h2ANTINGEN. Därför binder två H med en eller för att bilda H2ANTINGEN.
Ett kemiskt element, till skillnad från kemiska föreningar, är det enklaste och mest grundläggande sättet som utgör materia. Det presenteras som en unik typ av atom som inte kan delas upp i enklare ämnen genom kemiska reaktioner.
Typer av kemiska föreningar
Kemiska föreningar kan klassificeras främst efter två kriterier:
- Enligt den typ av bindning som förenar de kemiska elementen som finns i den kemiska föreningen.
- Enligt sammansättningen och strukturen för den kemiska föreningen.
Enligt typen av länk
Beroende på typ av länk kan kemiska föreningar vara:
- Molekyler. De är kemiska föreningar som bildas av två eller flera typer av olika kemiska element, som förenas av en kovalent bindning. Denna länk kännetecknas av delningen av ett eller flera par externa elektroner, eller Valencia, mellan två atomer.
- Joner. Elektriskt laddade kemiska föreningar kallas jonkemiska föreningar, och deras joner förenas av jonlänk. Denna bindning inträffar när man går in i ett kemiskt element i metalltypen med ett icke -metalliskt kemiskt element.
- Intermetalliska föreningar. Det är en typ av metalllegering som utgör ett fast material som är mellan två eller flera metallkemiska element för att hålla dem ihop.
- Samordning. De bildas av ett centralt metalliskt element, kallad koordinationscenter, och som omger en uppsättning förenade molekyler eller joner kända som ligander. Hemoglobin är till exempel ett protein som finns i röda blodkroppar och som transporterar syre i blodet. Hemoglobin har en koordinationsförening som heter Grupo Hemo. I mitten av hemo finns en järnatom som ingriper i transport av syre genom hemoglobin.
Enligt kompositionen och strukturen
Enligt detta kriterium klassificeras kemiska föreningar som organiska och oorganiska.
- Organiska föreningar. De är föreningar vars huvudsakliga kemiska element är kol, som vanligtvis bildar kopplingar till atomer av samma kol och väte. De är emellertid också närvarande, även om i mindre utsträckning syre, kväve, svavel, bor, fosfor, etc. Organiska föreningar kan vara:
- Alifatisk. Molekylerna i de alifatiska föreningarna kan ha linjära eller cykliska former, det vill säga i stängda former som trianglar, rutor, pentagoner, etc. De kan ha kolbindningar av tre typer: enkla (C-C), dubbel (C = C) eller trippel (C≡C).
- Aromatisk. Det är cykliska föreningar som växelvis uppvisar enkla kol-kolbindningar och dubbla kol-kolbindningar.
- Heterocyklisk. De är föreningar som har en cyklisk struktur, som kan presentera ersättningen av en kolatom med ett annat kemiskt element (O, S, N, etc.).
- Organometallisk. De är organiska föreningar som kan förekomma i sina sammansättningsmetallelement.
- Polymerer. De är stora molekyler (makromolekyler) som bildas av små och identiska enheter som upprepas i hela polymeren, och som kallas monomerier.
- Oorganiska föreningar. Oorganiska föreningar, till skillnad från organiska, har inte kol som det centrala kemiska elementet, utan ingriper snarare i deras sammansättning de flesta av de kända kemiska elementen. Oorganiska föreningar kan vara:
- Grundläggande oxider. De bildas av reaktionen av ett metallkemiskt element, såsom natrium, kalcium, järn, koppar, etc., Med syre. Till exempel är natriumoxid (NAO) en basoxid. De kallas basiska oxider eftersom de kommer att ge upphov till baserna eller hydroxiderna.
- Syraoxider. De har sitt ursprung genom reaktionen av ett icke -metalliskt kemiskt element, såsom klor, fluor, svavel, brom, etc., Med syre. Till exempel bromoxid (BR2ANTINGEN5) Det är en syraoxid. De kallas sura oxider eftersom de ger upphov till syror.
- Hydrare. De presenterar i sin kemiska sammansättning närvaron av väte. Det finns två typer: Metalliska hydros och icke -metalliska hydrorer.
- Metall. De bildas genom reaktionen av väte, med oxidationstillståndet -1, med en metall. Dessa kemiska föreningar är de enda där väte finns med oxidationstillståndet -1. Till exempel CAH2 Det är kalciumhydrid.
- Inte metallisk. De bildas genom reaktionen av väte, med oxidationstillstånd + 1, med ett icke -metalliskt element med dess lägre oxidationstillstånd. Klorhydrid (HCl) är en gas som när saltsyra upplöses i vatten.
- Syror. De är oorganiska kemiska föreningar, även om det finns organiska syror, som har ett pH mindre än 7 och vänder sig till färgen på rött -rött papper till rött. De kan klassificeras i hydracycider och oxacider.
- Hydracy. De härstammar från reaktionen av väte med en icke -metall för att bilda en hydrid som upplöses i vatten härstammar en syra; Till exempel iarhydric Acid (HI).
- Oxcacida. Det härstammar från reaktionen av en oxid av ett icke -metalliskt kemiskt element med vatten. Till exempel svaveloxidreaktion (så3) Med vatten producerar svavelsyra (h2Sw4).
- Du går ut. De är kemiska föreningar som härstammar genom interaktion mellan syra och basföreningar. I sin sammansättning kan det finnas så många metallelement som icke -metalliska. Salter klassificeras som:
- Neutralsalter. De har sitt ursprung i en reaktion av neutralisering mellan en syra och en bas med bildning av salt och vatten. Till exempel producerar natriumhydroxidreaktion (NaOH) med saltsyra (HCl) natriumklorid (NaCl), salt och vatten. De kallas neutrala eftersom de inte producerar en variation av pH.
- Syrasalter. De bildas av reaktionen av en metallhydroxid med Valencia +1, med en syra med flera hydrogener. Reaktionen av litiumhydroxid (LIOH) med kolsyra (h2Co3), producerar ersättningen av endast ett väte med litium, vilket orsakar litiumbikarbonat (Lihco3), Ett surt salt och vatten.
- Grundsalter. De produceras genom reaktionen av en bas som har mer än en grupp OH med en hydracy -syra, till exempel saltsyra. När du reagerar syra med kalciumhydroxid, CA (OH)2, En kloratom ersätter en hydroxylgrupp (OH). Detta producerar kalciumhydroxyklorid (cuckloh), ett grundsalt och vatten.
Skillnader mellan kemiska föreningar och kemiska element
 Upp de kemiska elementen och de kemiska föreningarna. Kemiska föreningar bildas av elementen ovan
Upp de kemiska elementen och de kemiska föreningarna. Kemiska föreningar bildas av elementen ovan Varje kemiskt element motsvarar en specifik atom och endast med den typen av atom; det vill säga ett kemiskt element har inte olika typer av atomer. Atomen är den elementära partikeln av materia som inte är dividerad med fysiska eller kemiska metoder.
Atomen i ett kemiskt element kan förenas med atomerna i andra kemiska element för att bilda kemiska föreningar, som kan separeras i deras komponenter (kemiska element) med hjälp av kemiska metoder.
De kemiska elementen och kemiska föreningar med ett pussel kan utrustas: pusselbitarna har olika egenskaper, så att de kan matcha de kemiska elementen.
Pusselbitarna kan gå med för att bilda olika figurer. De bildade siffrorna kan likställas med kemiska föreningar. När aktiviteten är klar kan pusselfigurerna separeras i bitarna som utgör den.
Exempel på kemiska föreningar
Nedan kan du se en serie exempel på dagliga kemiska föreningar:
- HCl: saltsyra
- H2S: sulfhydronsyra
- HF: fluorhydronsyra
- H2Sw4: Svavelsyra
- Hclo4: Perklorsyra
- H3Po4: Fosforsyra
- H2Co3: Kolsyra
- Hno3: Salpetersyra
- NaOH: natriumhydroxid
- Ca (oh)2: Kalcium hydroxid
- Tro (OH)2: Järnhydroxid
- Tro (OH)3: Järnhydroxid
- NAH: natriumhydrid
- Cu2O: Kopprooxid
- Cuo: cupric oxid
- Tro2ANTINGEN3: Järnoxid
- Kli2ANTINGEN7: Perkloroxid
- Bras2O: Hipobromous oxid
- Yo2ANTINGEN3: Hypoyodosoxid
- NaCl: natriumklorid
- Fecl3: Järnklorid
- Hco3: Natriumbikarbonat
- Ch3Sökväg: natriumacetat
- Na2Sw4: Natriumsulfat
- Feso4: Järnhaltig sulfid
- H2O: Vatten
- Co2: Koldioxid
- C6H12ANTINGEN6: Glukos
- C12H22ANTINGENelva: Sackaros
Andra intressanta ämnen
Kemiska reaktioner
Kemi i vardagen: exempel
Organiska föreningar
Oorganiska föreningar
Kemisk bindning
Ren substans
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Wikipedia. (2021). Kemisk förening. Hämtad från: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (27 augusti 2020). Sammansatt definition i kemi. Återhämtat sig från: tankco.com
- Toppr. (s.F.). Vad är sammansatt i kemi? Typer av kemisk förening. Återhämtat sig från: toppr.com

