Binära föreningar bildning, typer, exempel, nomenklatur
- 1907
- 575
- PhD. Lennart Johansson
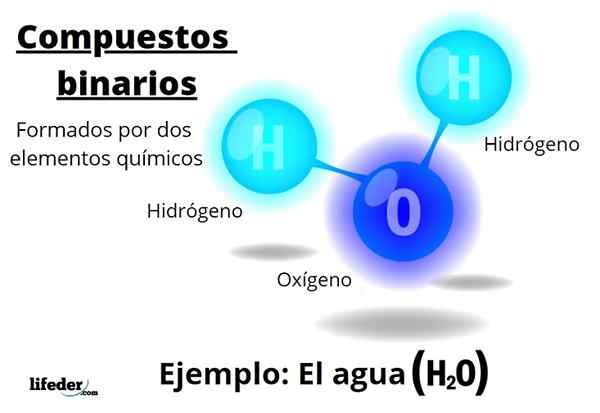
De binära föreningar De bildas alla av två kemiska element, oavsett antalet atomer eller deras interaktioner. Den allmänna formeln för dessa föreningar ärnBm, där A och B är två olika element i den periodiska tabellen, och n och m deras respektive stökiometriska koefficienter.
Till exempel vatten, h2Eller det är en binär förening, som kanske är den mest representativa för dem. Vatten består av väte, H och syre, eller, därmed tillsätta två kemiska element. Observera att dess stökiometriska koefficienter indikerar att det finns två väte- och en syreatomer, men det är fortfarande en binär förening.

Binära föreningar kan bestå av joner, molekyler, tre dimensionella nätverk eller till och med neutrala metallatomer. Det viktiga är att oavsett karaktären av dess kemiska bindning eller dess sammansättning alltid bildas av två olika kemiska element. Till exempel vätgas, h2, räknas inte som binär förening.
Binära föreningar kanske inte verkar, initialt, så rikligt och komplex jämfört med ternära eller kvartära föreningar. Bland dem finns emellertid många viktiga ämnen för markbundna ekosystem, såsom salter, oxider, sulfider och några gaser med enorma biologiska och industriella värde.
[TOC]
Hur är binära föreningar?
Beredningsmetoder eller syntetiska rutter för att bilda binära föreningar beror på identiteten för de två kemiska elementen A och B. I princip måste emellertid båda elementen kombineras i en reaktor så att de kan interagera med varandra. Således, om förhållandena är gynnsamma, kommer en kemisk reaktion att äga rum.
Med en kemisk reaktion kommer element A och B att förenas eller länkas (joniskt eller kovalent) för att bilda föreningen tillnBm. Många binära föreningar kan bildas genom direkt kombination av sina två rena element, eller följa andra mer ekonomiskt hållbara alternativa metoder.
Det kan tjäna dig: Zink Oxide (ZnO): Struktur, egenskaper, användningar, riskerÅtervänder till exemplet med vatten, väte, h2, och syre, eller2, De kombineras vid höga temperaturer så att det finns en förbränningsreaktion mellan dem:
2h2(g) + eller2(g) → 2h2O (g)
Vatten kan å andra sidan erhållas genom dehydratiseringsreaktioner av föreningar som alkoholer och sockerarter.
Ett annat exempel på bildning av en binär förening motsvarar järnhaltig sulfid, FES:
Tro (s) + s (s) → fes (s)
Där den här gången är både järn och svavel solida och inte läskämnen. Och detta är samma sak med flera binära salter, till exempel natriumklorid, NaCl, som kombinerar metalliskt natrium med klorgaser:
2na (s) + cl2(g) → 2NACL (S)
Nomenklatur
Namnen på alla binära föreningar styrs mest av samma regler.
För att föreningen tillnBm, Namnet B nämns först i dess anjoniska form; det vill säga med slutet -uro. Men i det fall B består av syre, kallas det som en oxid, peroxid eller superoxid som appliceras.
Namnet på B föregås av grekiska siffror (mono, di, tri, tetra, etc.) enligt värdet av m.
Slutligen nämns namnet på elementet A. I händelse av att den har mer än en valens indikeras det med romerska antal och inom parentes. Eller om du föredrar kan du välja den traditionella nomenklaturen och använda suffixerna -ooso e -ico. Element A ibland föregås också av grekiska siffriga prefix enligt värdet av n.
Tänk på följande binära föreningar tillsammans med deras respektive namn:
-H2O: Väteoxid eller dihydrogenmonoxid (detta efternamn är en orsak till retning)
-FES: järnsulfid (II) eller järnsulfid
-NaCl: natriumklorid eller natriumklorid
Kan tjäna dig: olja eller bensineter: formel, struktur, användningar-Mgcl2: magnesiumklorid, magnetisk klorid eller magnesiumdiklorid
Observera att det inte sägs 'Monosodium Chloride' eller 'Monohierro Sulfide'.
Typer: Klassificering av binära föreningar
Binära föreningar klassificeras enligt vad som bildas eller fakta: joner, molekyler, metallatomer eller nätverk. Trots detta är denna klassificering inte helt avgörande eller definitiv, att kunna variera beroende på den tillvägagångssätt som övervägs.
Jonisk
I joniska binära föreningar består A och B av joner. Således för att föreningen skanBm, B är vanligtvis en anjon, b-, Medan en katjon till+. Till exempel tillhör NaCl denna klassificering, liksom alla binära salter, vars allmänna formler är bättre representerade som MX, där X är en anjon och M en metallkationering.
Således fluorider, klorider, bromuros, jodid., De tillhör också denna klassificering. Det bör emellertid noteras att några av dem är kovalenta och därför tillhör följande klassificering.
Kovalent
Kovalenta binära föreningar bildas av molekyler. Vattnet tillhör denna klassificering, eftersom det består av H-O-H-molekyler. Väteklorid, HCl, betraktas också som en kovalent binär förening, eftersom den består av H-CL-molekyler. Observera att NaCl är jonisk, medan HCl är kovalent, båda kloriderna är.
Metalliska eller nätverk
Binära föreningar täcker också legeringar och fasta ämnen i tre dimensionella nätverk. För dem används emellertid valören av binära material bättre.
Till exempel betraktas mässing, mer än en förening, som ett binärt material eller legering, eftersom det bildas av koppar och zink, Cu-Zn. Observera att det inte är skrivet genom att inte ha definierat stökiometriska koefficienter.
På samma sätt finns det kiseldioxid, SIO2, bildad av kisel och syre. Deras atomer är länkade genom att definiera ett trepedimensionellt nätverk, där du inte kan prata om molekyler eller joner. Många nitrider, fosfon och karbider, när de inte är joniska, handlar också om denna typ av nätverk.
Kan tjäna dig: fenoxyättiksyra: syntes, procedur, användningar, riskerExempel på binära föreningar
 Vatten är ett exempel på en binär förening
Vatten är ett exempel på en binär förening Det kommer att listas för att avsluta flera binära föreningar åtföljda av deras respektive namn:
-Libr: litiumbromid
-CaCl2: kalciumklorid
-Fecl3: järnklorid (III) eller järnklorid
-NAO: natriumoxid
-Bete2: berylliumhydrid
-Co2: koldioxid
-Nh3: Kväve eller ammoniak trihydrid
-Bal2: Blyjodid (ii) eller bly diyoduro
-Mg3N2: Magnesium nitruro
-Till2ANTINGEN3: Aluminiumoxid eller diauminiumtrioxid
-Na3F: Natriumfosfuro
-Alf3: Aluminiumfluorid
-RACL2: radioklorid eller radiodiklorid
-Bf3: Boro Trifluoruro
-RBI: Rubidio Yoduro
-Wc: volframkarbid eller wolframium
Var och en av dessa exempel kan ha mer än ett namn åt gången. Av dessa, CO2 Det har en stor inverkan på naturen, eftersom den används av växter i fotosyntesprocessen.
Å andra sidan, NH3 Det är ett av ämnena med det mest industriella värdet, nödvändigt för syntes av polymer och organisk syntes. Och slutligen är WC ett av de tuffaste materialen som någonsin skapats.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Artem Cheprasov. (2020). Vad är en binär förening? - Definition och exempel. Studie. Återhämtat sig från: studie.com
- Helmestine, Anne Marie, PH.D. (11 februari 2020). Definition av binär förening. Återhämtat sig från: tankco.com
- Byju. (2020). Vad är binära föreningar? Återhämtat sig från: byju.com
- Kemteam. (s.F.). Binära föreningar av metaller med fasta laddningar. Återhämtat sig från: kemteam.Info
- Wikipedia. (2020). Binärfas. Hämtad från: i.Wikipedia.org
- « Nitritegenskaper, struktur, nomenklatur, träning
- Reaktionsflockning, typer, applikationer, exempel »

