Nitritegenskaper, struktur, nomenklatur, träning
- 1986
- 513
- Johan Gustafsson
De nitriter De är alla de föreningar som inte innehåller anjon2-, Om de är oorganiska eller gruppen -ono, om de är organiska. De allra flesta är metallnitriter, som är oorganiska salter där nej2- interagera elektrostatiskt med C -katjonern+; Till exempel natriumkatjonen, NA+.
Således natriumnitrit, nano2, Det är ett exempel på en salt eller nitritförening. Dessa salter finns i naturen, antingen i jord, hav, däggdjur och växtvävnader, eftersom de är en del av den biologiska kvävecykeln. Därför nej2- Det är ett ämne som finns i våra organismer och är kopplad till vasodilatorprocesser.
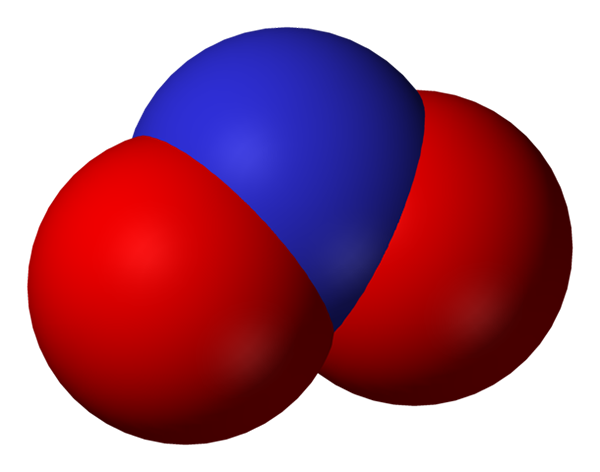
 Utrymme fullt av nitritanjon. Källa: Benjah-Bmm27.
Utrymme fullt av nitritanjon. Källa: Benjah-Bmm27. Nitrit blir en mindre form av kväve eller mindre oxiderad än nitrat, inte3-. Kväveoxid uppstår från den, NO i regioner i organismen där det finns syrebrist. Han är inte en signalmolekyl som utövar en vasodilatoreffekt av avkopplande muskler och artärer.
Av biokemi och medicin används nitriter som baktericider, som är deras aggregering till ganska vanligt kött. Detta med syftet att bota dem och utöka deras kvalitet och friskhet längre.
Nitriten har två ansikten: en gynnsam för hälsan och en annan som sätter den i fara. Det goda ansiktet beror just på de reaktioner som minskar det till inte. Samtidigt beror det dåliga ansiktet på dess omvandling till nitrosamin: en familj av organiska föreningar som har flera medlemmar som har erkänts som cancerframkallande ämnen.
[TOC]
Nitritegenskaper
Basicitet
Nitriter är grundläggande salter, eftersom anjon inte gör det2- Det är den konjugerade basen på kvävesyran, HNO2:
Hno2 + H2Eller ⇌ Nej2- + H3ANTINGEN+
I vatten och i några mängder är det hydrolyserat för att komma från OH -joner-:
NEJ2- + H2Eller ⇌ hno2 + Åh-
Denna basicitet är inneboende för alla nitritsalter, eftersom det beror på inte2- och inte av katjonerna som följer med honom. Men dessa katjoner och deras interaktioner med NO2- De påverkar lösligheterna hos nitritsalter i vatten och andra polära lösningsmedel.
Reaktioner
Nitritreaktioner varierar beroende på vilka katjoner som följer nr2-, eller om det är en organisk nitrit, Rono. I allmänna termer kan nitriter sönderdelas, oxidera eller reducera till: metalloxider, inte3-, NEJ2, Nej, och till och med kvävgas, n2.
Kan tjäna dig: termodynamiska processerTill exempel ammoniumnitrit, NH4NEJ2 kan sönderdelas till n2 och h2ANTINGEN.
Fysiska uppträdanden
Nästan alla nitriter är fasta utseende. Många är vitaktiga eller gulaktiga färger, även om det finns färgglada om de innehåller övergångsmetallkatjoner.
Å andra sidan är mestadels organiska nitriter mycket instabila och explosiva flyktiga vätskor.
Strukturera
Nitritanjon
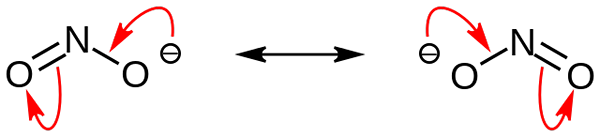 Nitritjonresonansstrukturer. Källa: NohingSerius / Pub -domänen
Nitritjonresonansstrukturer. Källa: NohingSerius / Pub -domänen I den första bilden visades nitritanjonen med en full rymdmodell. Denna modell har den nackdel som är exakt densamma som för kvävedioxid, nej2. Å andra sidan beskriver den överlägsna bilden nitritjonen bättre och hur dess negativa belastning beter sig.
Denna belastning flyttas mellan de två syreatomerna, så var och en har hälften av den negativa belastningen (-1/2). Och det är denna negativa börda som ansvarar för att locka omgivande katjoner på grund av enkel elektrostatisk attraktion.
Fasta ämnen
Oorganiska nitriter är alla kristallina fasta föreningar. Dess interaktioner är rent elektrostatiska och har en attraktion mellan nr2- och katjoner mn+. Således till exempel nano2 Den har en ortorrombisk kristallin struktur och bildas av Na -joner+ och inte2-.
Typen av kristallin struktur beror på identiteten på M+n, Så inte alla nitriter delar en ortorrombisk struktur.
Organiska nitriter
Organiska nitriter, till skillnad från oorganiska, är inte joniska föreningar utan kovalent. De är därför bildade av molekyler, som kännetecknas av att ha en R-Aon-länk, där R kan vara en alkyl eller aromatisk grupp.
De betraktas som kvävesyraestrar, eftersom deras väte, H-Don, ersätts av en R-grupp:
 Allmän formel för en organisk nitrit. Källa: Pngbot via Wikipedia.
Allmän formel för en organisk nitrit. Källa: Pngbot via Wikipedia. Enligt den överlägsna bilden kan denna ester skrivas som rom = o, mycket lik formeln för kolestrar, roc = o. Notera den stora likheten som denna struktur har med nitroföreningarna, RNO2, där nu huvudlänken är r-no2 och inte R-Dono. Den enda skillnaden ligger därför i atomen som den går med2 till grupp r.
Det är av denna anledning som nitritestrar och nitroföreningar betraktas som länkisomerer, eftersom de har samma atomer, men kopplade annorlunda.
Komplex
Nitritkomplex kan ha både oorganiska och organiska komponenter. De bildar en koordinationslänk mellan ett metallcenter och en av NO -syre2-. Det vill säga det är inget samtal om en rent elektrostatisk interaktion, mn+NEJ2-, men av koordination mn+-ELLER INTE-.
Kan tjäna dig: Vilka är de fysiska egenskaperna hos materien?Organiska nitriter och deras komplex kommer att etablera eller inte kristallina strukturer beroende på om deras interaktioner lyckas sätta sina partiklar i rymden.
Nomenklatur
Oorganiska och organiska nitriter delar en betydligt enkel nomenklatur. För att namnge dem placeras orden 'nitrit av', följt av namnet på metallen och dess valens skrivet inom parentes först. Likaså kan avslutningen -co och -så i händelse av att det finns mer än en Valencia kan användas.
Till exempel Cuno2 kan namnges på två sätt: kopparnitrit (I) eller kopparnitrit.
Denna nomenklaturregel gäller också organiska nitriter. Till exempel Cho3Ono kallas methilo nitrito, eftersom ch3 motsvarar grupp R kopplad till NO -syre2.
Nomenklaturen kan bli komplicerad om det finns andra grupper av lika eller större kemisk relevans än NO2, eller om de är metallkomplex.
Träning
Nitrifiering
Många oorganiska nitriter bildas i naturen i ett av stegen i kvävecykeln: nitrifikation. Denna process består av oxidationen av ammoniak som utförs av mikroorganismer, specifikt av Nitrosomonas -bakterier.
Nitrifikation täcker också den efterföljande oxidationen av nitrat till nitrat; Nitritbildning är emellertid det långsamma steget i dessa reaktioner, eftersom det kräver större energi och måste övervinna en större kinetisk barriär.
Följande ekvation exemplifierar de nyligen exponerade:
2Nh4+ + 3: e2 → 2no2- + 4 timmar+ + 2h2ANTINGEN
Flera enzymer deltar i denna reaktion och hydroxylamin produceras, NH2Åh, vilken är produkten från vilken nitritanjoner äntligen kommer att komma från.
Det är tack vare nitrifikationen att växter innehåller nitriter, och i sin tur djuren som konsumerar dem. Nitriter finns inte bara i jorden, utan också i havet, och nästan all deras naturliga produktion beror på den oxidativa och anaeroba verkan av olika mikroorganismer.
Kväveoxider i grundläggande media
Nitriterna av alkaliska metaller kan framställas industriellt genom att bubbla kväveoxider i grundläggande lösningar eller media, antingen från deras respektive hydroxider eller karbonater. Till exempel förekommer natriumnitrit enligt följande reaktion:
Nej +nej2 + NaOH → 2Nano2 + H2ANTINGEN
När det gäller ammoniumnitrit bubblas dyitrogentrioxid i ammoniak:
Kan tjäna dig: Rodio: Historia, egenskaper, struktur, användningar, risk2Nh3 + H2Eller +n2ANTINGEN3 → 2NH4NEJ2
Reaktion med kväveoxid
Alquilico -nitriter, Rono, kan syntetiseras genom React. Den allmänna reaktionen skulle vara följande:
R-OH → R-aon
Nitritapplikation
Köttrying
 Den rödaktiga färgen på köttet beror på dess bot med nitratsalter och nitrat. Källa: Pxhere.
Den rödaktiga färgen på köttet beror på dess bot med nitratsalter och nitrat. Källa: Pxhere. Nitriter har antibakteriella effekter, så de tillsätts i måttliga mängder till kött för att bromsa sin råtta. Förutom att uppfylla denna funktion, reagerar de med köttproteiner för att ge dem en mer rödaktig och attraktiv färgning.
Den dåliga sidan av denna praxis är att vissa kött kan ha för många nitritsalter, och när de lagar dem vid höga temperaturer förvandlas de till nitrosoaminas. Därför finns det en risk att öka chansen att drabbas av någon typ av cancer om konsumtionen av dessa härdade kött är överdriven.
Stavfärgämnen
Nitriter används i organisk kemi för att genomföra diazotationsreaktionen, med vilken färg eller färgämnen syntetiseras.
Pigment
Vissa nitritkomplex, såsom kobolt, kan användas som pigment för målningar eller porslin på grund av deras slående färg.
Kärlvidgande medel
Nitriter ansvarar för att generera kväveoxid i kroppen i bristfälliga syreregioner. Han är inte en signalmolekyl, som svarar på blodkärl som kopplar av och expanderar. Denna expansion eller utvidgning har som en följd av att blodtrycket minskar.
Exempel på nitriter
Slutligen kommer några exempel på nitriter att listas med sina respektive formler och namn:
-Äldre bror2: natriumnitrit
-Kno2: kaliumnitrit
-Mg (nej2)2: Magnesiumnitrit
-Pip2)2: kalciumnitrit
-Ch3Ch2Ono: etylnitrit
-Nh4NEJ2: ammoniumnitrit
-Zn (nej2)2: zinknitrit
-PB (nej2)2: Bly nitrit (ii) eller plumbosnitrit
-Tro (nej2)3: Järnnitrit (III) eller järnnitrit
-(Ch3)2Chch2Ch2Ono: Isoamilo nitrito
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Nitrit. Hämtad från: i.Wikipedia.org
- Elsevier b.V. (2020). Nitrit. Vetenskaplig. Hämtad från: Scientedirect.com
- Alfa aesar. (2020). Nitritsalter. Themo Fisher Scientific. Återhämtat sig från: alfa.com
- Redaktörerna för Enyclopaedia Britannica. (23 februari 2018). Nitriter. Encyclopædia Britannica. Återhämtat sig från: Britannica.com
- Anthony R. Butler & Martin Feelisch. (22 april 2018). Terapeutisk användning av oorganisk nitrit och nitrat. doi.org/10.1161/Circulationaha.107.753814
- Kris Gunnars. (10 februari 2020). Är nitrater och nitriter i livsmedel skadliga? Återhämtat sig från: Healthline.com
- « Socialt beteende teori, typer, normer, exempel
- Binära föreningar bildning, typer, exempel, nomenklatur »

