Organiska föreningar

- 4174
- 495
- Johan Johansson
Vi förklarar vad organiska föreningar är, deras egenskaper, de typer som är skillnaderna med de oorganiska föreningarna och ger flera exempel
 Organiska föreningar kommer från levande varelser
Organiska föreningar kommer från levande varelser Vad är organiska föreningar?
De Organiska föreningar Det är de som kommer från levande varelser och innehåller kol- och väteatomer kopplade till varandra i form av öppna kedjor eller stängda cykler.
Förutom kol och väte kan organiska föreningar också innehålla andra element såsom syre (O), kväve (N), svavel (S), fosfor (P), fluor (F), klor (CL), brom (BR) eller jod (i). Alla dessa kallas heteroátomos.
Livet skulle inte vara möjligt utan organiska föreningar, så alla levande varelser innehåller dem. Det finns tusentals av dessa ämnen och vi kan hitta dem överallt, börjar med våra egna kroppar.
Egenskaper hos organiska föreningar
De är baserade på kolkemi
Kol utgör grunden för alla organiska föreningar. I dessa föreningar kan kolatomer kopplas till varandra eller med andra element. Varje kolatom bildar alltid 4 bindningar totalt, mellan enkla, dubbla och trippelbindningar.
De har kovalenta länkar
Det finns tre typer av huvudkemiska länkar som är den kovalenta, joniska och metalliska bindningen. Organiska föreningar kännetecknas av endast kovalenta bindningar mellan alla deras atomer.
De är bränslen
 Kol är ett bränsle som erhålls från de organiska föreningarna som finns i träet
Kol är ett bränsle som erhålls från de organiska föreningarna som finns i träet Genom att innehålla så många kolatomer är organiska föreningar brännbara. Detta innebär att de kan brinna med hjälp av en förbränningsreaktion med luftens syre.
Förbränningsreaktionerna från organiska föreningar är exotermiska reaktioner som frigör mycket värme. Alla levande varelser drar nytta av all denna energi för att utföra alla reaktioner som håller oss vid liv.
De har isomeria
Många organiska föreningar har samma molekylformel, men de är helt olika föreningar. Den här egenskapen kallas Isomeía och är karakteristisk för organiska föreningar.
Till exempel har både den metiliska etanoletanolen molekylformeln C2H6Eller, men den första är en gas medan den andra är en vätska.
De kan bilda polymerer
Ett annat kännetecken för organiska föreningar är att de kan bilda gigantiska molekyler som upprepar en grupp atomer om och om igen i en lång kedja. Dessa föreningar kallas polymerer och ett typiskt exempel på dem är plast.
Löslighet
En annan egenskap som kännetecknar organiska föreningar är deras löslighet. Många av dem, särskilt polära organiska föreningar, är lösliga i vatten. Andra föreningar upplöses inte i vatten, men i organiska lösningsmedel som cyklohexan.
Kan tjäna dig: Succinic Acid: Struktur, egenskaper, erhållning, användningTyper av organiska föreningar
Organiska föreningar har egenskaper och egenskaper som gör dem mycket olika från oorganiska föreningar (de som inte kommer från levande varelser, till exempel mineraler).
Många av dessa egenskaper tillåter dem att klassificera dem på olika sätt, vilket ger upphov till olika typer av organiska föreningar. De viktigaste klassificeringskriterierna är:
- Enligt dess ursprung.
- Enligt dess struktur och sammansättning.
- Enligt den funktionella gruppen.
- Enligt hans polaritet.
Därefter beskrivs de typer av organiska föreningar klassificerade enligt vart och ett av dessa kriterier:
Typer av organiska föreningar enligt deras ursprung
Om de kommer från kan organiska föreningar vara:
- Naturliga organiska föreningar: De är de som finns i naturen och det kommer direkt från levande varelser. Cellulosa är ett bra exempel, eftersom det är den vanligaste naturliga organiska föreningen på jorden.
- Syntetiska organiska föreningar: De hänvisar till de organiska föreningarna som syntetiseras av kemikalier i ett laboratorium eller i en kemisk växt. All plast som vi använder dagligen är syntetiska, och även många mediciner.
Typer av organiska föreningar enligt deras struktur och sammansättning
Enligt atomerna som omfattar dem och hur dessa atomer är förenade tillsammans kan organiska föreningar vara:
- Alifatiska kolväten: bildas endast av kol och väte och där kol som bildar öppna kedjor antingen linjära eller grenade. De inkluderar Alquenos och Alkines.
- Aromatiska kolväten: Föreningarna som tillhör denna familj, även kallad Sands, innehåller omättade cykler (som fortfarande kan ha mer väte) som har stor molekylär stabilitet. Den här egenskapen kallas aromatiskhet och är karakteristisk för bensen och alla dess derivat.
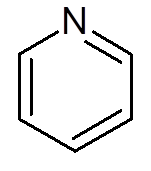
- Heterocykliska föreningar: De är cykliska föreningar där en eller flera kolatomer ersätts av en heteroátomo som kan vara syre, kväve, svavel eller fosfor. Exempel på heterocykler är pyridin och furano.
- Organometallföreningar: De är en speciell klass av föreningar som är halvvägs mellan att vara organiska och oorganiska. De kännetecknas av att innehålla en organisk del med en heteroátom.
Typer av organiska föreningar enligt den funktionella gruppen
Den del av en organisk molekyl där kemiska reaktioner vanligtvis förekommer är en liten grupp atomer som kallas en funktionell grupp. Det finns flera olika funktionella grupper som tillåter klassificering av organiska föreningar i:
- Slutna: De innehåller endast kol och väte kopplade endast av enkla bindningar. Till exempel butan.
- Alkener: De är kolväten som innehåller en dubbel kol-kol-bindning. Till exempel Buutene.
- Alkyn: De är kolväten som innehåller en trippel kol-kol-bindning. Till exempel Etino, även känd som acetylen.
- Alkylhalogenuro: Organiska föreningar som innehåller en halogen (F, Cl, BR eller I) kopplad till ett alifatiskt kol. Till exempel klormetan.
- Alkohol: Alkoholer är polära organiska föreningar som innehåller en hydroxylgrupp (-OH) tillsammans med ett alifatiskt kol.
- Fenoler: Dessa föreningar innehåller också en hydroxylgrupp (-OH), men i detta fall tillsammans med ett aromatiskt kol.
- Eters: De är lätt igenkända, eftersom de är två kolkedjor tillsammans med varandra av en syreatom. Till exempel metyletern.
- Aminer: De är organiska föreningar härrörande från ammoniak (NH3). De innehåller en eller flera alifatiska kol (alkylgrupper) kopplade till en kväveatom med enkla bindningar.
- Aldehyder: Syresatta organiska föreningar som innehåller en karbonylgrupp (C = O) tillsammans med ett väte i en av dess terminal kol. I allmänhet har de karakteristiska luktar, till exempel cinamaldehyden som ger lukten av kanel.
- Ketoner: De är syresatta organiska föreningar som innehåller en karbonylgrupp (C = O) tillsammans med två kolkedjor.
- Karboxylsyror: Kallas också organiska syror, de är svaga syror som innehåller en karboxylgrupp (-COOH) i en av dess terminal kol.
- Estrar: De kommer från föreningen av en karboxylsyra med en alkohol. I detta fall ersätts väte i karboxylgruppen av en hyresgrupp.
- Amidas: De kommer från föreningen av en karboxylsyra med en amin. I detta fall ersätts OH i karboxylgruppen av ett kväve fäst vid två väten, ett väte och en alkyl eller två alkal.
Typer av organiska föreningar enligt deras polaritet
Vi kan också klassificera organiska föreningar i polära och apolära:
- Polära organiska föreningar: Dessa föreningar har polära kovalenta bindningar med atomer såsom kväve och syre som gör hela molekylen polär. De flesta av dessa föreningar är lösliga i vatten.
- Apolära organiska föreningar: De är de som inte har polära länkar eller polariteterna i deras länkar avbryts med varandra. Dessa föreningar är inte lösliga i vatten.
Skillnader mellan organiska föreningar och oorganiska föreningar
Följande tabell sammanfattar skillnaderna mellan organiska och oorganiska föreningar:
Organiska föreningar | Oorganiska föreningar | |
Ursprung: | Komma från levande varelser eller deras rester. | De kommer inte från levande varelser. |
Sammansättning: | Bildades nästan uteslutande av C, N, O, S, P, F, CL, BR och I. | De kan bildas av alla element i den periodiska tabellen. |
Typer av länkar: | De bildar kovalenta bindningar både polära och apolära. | De kan bilda alla typer av kemiska länkar, inklusive polära, apolära, joniska eller metalliska kovalenta bindningar. |
Isomery: | Mest nuvarande isomeía. | Endast några nuvarande isomeía. |
Bränslen: | De är bränslen. | De flesta är inte brännbara. |
Exempel på organiska föreningar
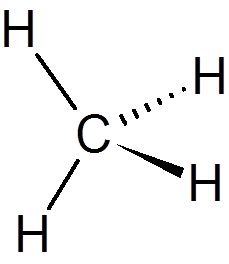
1. Metan (ch4)
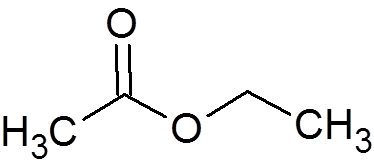
2. Etylacetat (c4H8ANTINGEN2)
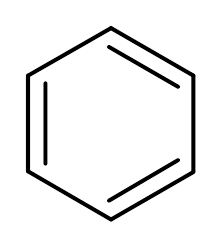
3. Bensen (c6H6)
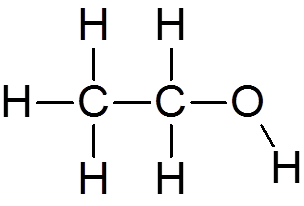
4. Etylalkohol (c2H6ANTINGEN)
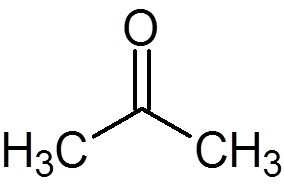
5. Aceton (c3H6ANTINGEN)
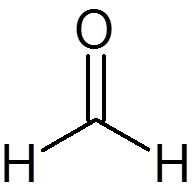
6. Formaldehyd (ch2ANTINGEN)
7. Hemoglobin (ett protein)
8. Polyeten (en av de vanligaste plasten)
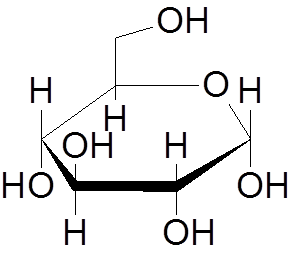
9. Glukos (c6H12ANTINGEN6)
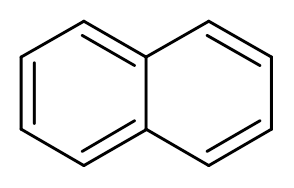
10. Naftalen (c10H8)
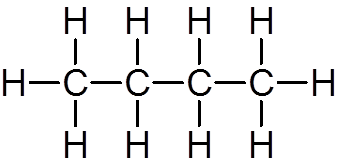
elva. Butano (c4H10)
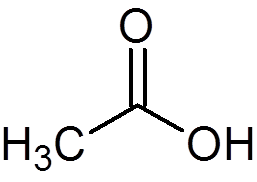
12. Ättiksyra eller vinäger (c2H4ANTINGEN2)
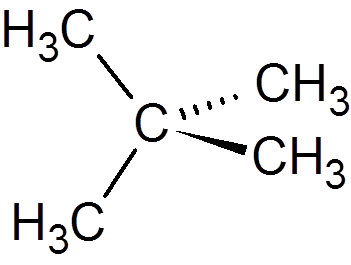
13. Neopentano (c5H12)
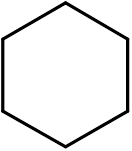
14. Cyklohexan (c6H12)
femton. Pyridin (C5H5N)
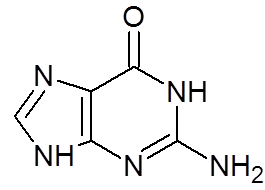
16. Guanina (c5H5N5ANTINGEN)
17. Fruktos (c6H12ANTINGEN6)
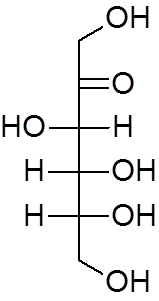
18. Etyleter (c4H10ANTINGEN)
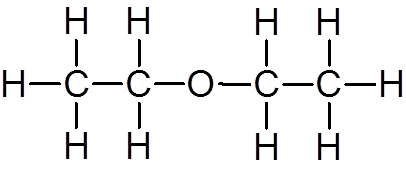
19. Metanol (ch4ANTINGEN)
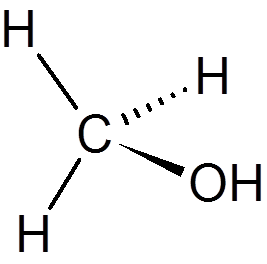
tjugo. Kloroform (CHCL3)
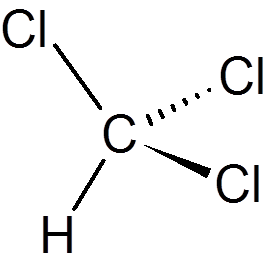
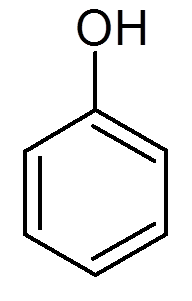
tjugoett. Fenol (c6H6ANTINGEN)
22. Acetylen (c2H2)
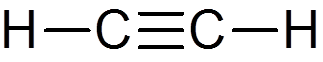
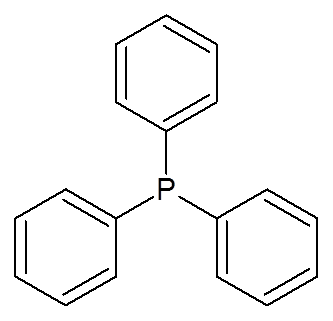
23. Trifenylfosfin ((C6H6)3P)
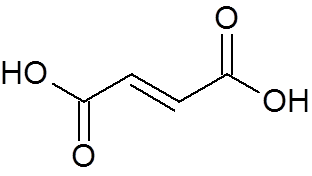
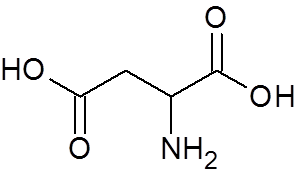
24. Trans-buteodioic acid (c4H4ANTINGEN4)
25. Aspartinsyra (en aminosyra) (C4H7NEJ4)
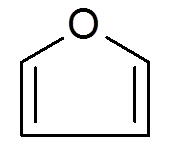
26. Furano (c4H4ANTINGEN)
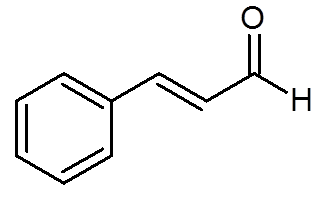
27. Cinamaldehyd (aroma av kanel) (c9H8ANTINGEN)
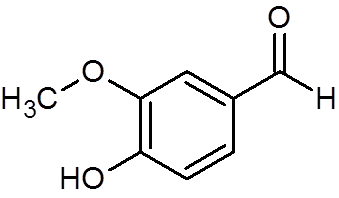
28. Vaniline (c8H8ANTINGEN3)
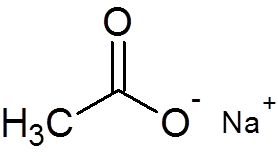
29. Natriumacetat (c2H3ANTINGEN2Na)
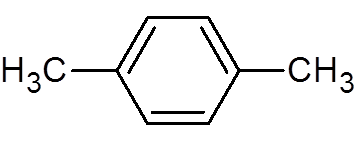
30. P-xylen (c8H10)
Referenser
- Carey, f., & Giuliano, r. (2013). Organisk kemi, 9: e upplagan (9: e upplagan.). New York City, New York: McGraw-Hill Education.
- Slott a., M. G. (s.F.). Huvudklasser av organiska föreningar och funktionella grupper. Återhämtat sig från uaeh.Edu.mx
- Chang, R., & Goldsby, K. TILL. (2012). Kemi, 11: e upplagan (11: e upplagan.). New York City, New York: McGraw-Hill Education.
- Klein, D. R. (2011). Organisk kemi (1.till ed.). Hoboken, New Jersey: Wiley.
- Morrison, r. T., & Boyd, r. N. (2003). Organisk kemi (6: e upplagan.). Boston, Massachusets: Allyn & Bacon.

