Hastighetskonstant

- 2520
- 619
- Johan Johansson
Vad är hastighetskonstanten?
De hastighetskonstant Det är en konstant av proportionaliteten i hastighetslagen för kemisk kinetik, som skapar ett samband mellan den molära koncentrationen av reagensen och reaktionens hastighet.
När reagensen, reaktionshastigheterna konsumerar, minskar också. Det är därför i beräkningarna av hastighetskonstanten, representerad av 'K' -symbolen, beaktas de initiala hastigheterna för att ha en jämförelsepunkt mellan flera experiment.

De kemiska kinetikerna indikerar att denna konstant beror på reaktionsordningarna för reagensen, vars koncentrationer kommer att förändra reaktionens hastighet. Å andra sidan, enligt Arrhenius -ekvationen, beror K också på temperaturen och aktiveringsenergin för reaktionen.
Det är därför det sägs att hastighetskonstanten inte är en verklig konstant, eftersom den varierar med temperaturen och även med närvaron av katalysatorer som modifierar aktiveringsenergin. Därför finns det inte många tabeller där de kommer för specifika reaktioner (och förhållanden).
Till exempel, för en reaktion där A och B reagerar, var och en med en reaktionsordning på 1, rapporterade konstanten k till 25 ° C, och med tillsats av en viss mängd katalysator kommer det inte att vara densamma om reaktionen görs till en temperatur på 26 eller 27 ºC. Den minsta variationen kommer att påverka värdet på k, som endast är konstant under de förhållanden som fastställts för experiment.
Hur man beräknar hastighetskonstanten?
Experimenterande
Bestämningen av värdet på hastighetskonstanten för en reaktion görs experimentellt. Om du till exempel vill bestämma värdet på hastighetskonstanten för en reaktion av formen:
A +B → C
För upprättandet av värdet på K kan tre reaktioner göras, med följande skillnader: I reaktion 2 är den initiala koncentrationen av reagens A konstant, [A], men fördubblas till exempel koncentrationen av reagens B, [ B].
Under tiden fördubblas i reaktion 3 [A] jämfört med reaktion 1, vilket håller konstant [B].
Således kommer en koncentrationstabell att byggas som kommer att tjäna till att jämföra de initiala hastigheterna mellan flera experiment. Detta med syftet att bestämma reaktionsorder och i följd för att beräkna hastighetskonstanten.
Kan tjäna dig: aluminiumhydroxid: struktur, egenskaper, användningar, riskerReaktionsorder
Första beräkningen
För den tidigare reaktionen uttrycks dess hastighet av ekvationen:
Reaktionshastighet = k · [a]x· [B]och
Där 'x' e 'och' motsvarar reaktionsorderna för reagens a respektive b.
För att bestämma värdena på reaktionsorderna måste en jämförelse mellan reaktion 2 och 1, såväl som mellan reaktion 3 och 1.
Vid jämförelse av reaktion 1 med de 2 kan det till exempel observeras att genom att duplicera [b] finns det en duplikation av reaktionshastigheten.
Sedan: andelen [B] mellan reaktionerna 2 och 1 är 2, liksom andelen mellan reaktionerna. Sedan kan reaktionsens ordning erhållas med avseende på B (exponent och) genom följande tillvägagångssätt:
 Beräkning av reaktionsordningen 'och'. Källa: Gabriel Bolívar.
Beräkning av reaktionsordningen 'och'. Källa: Gabriel Bolívar. Hastigheten för experimentet 2 är två gånger snabbare än hastigheten på experimentet 1. Således, dela de två ekvationerna ovan kommer vi att ha:
2 = 2och
Därför är 'och' Vale 1, att kunna dra slutsatsen att reaktionsordningen med avseende på reagens B är av första ordningen.
Andra beräkning
På samma sätt fortsätter vi med reagenset A för beräkningen av 'X':
 Beräkning av reaktionsordningen 'x'. Källa: Gabriel Bolívar.
Beräkning av reaktionsordningen 'x'. Källa: Gabriel Bolívar. Hastigheten för experimentet eller reaktionen 3 är fyra gånger högre än experimentet eller reaktionen 1. Därför:
4 = 2x
ANTINGEN
22 = 2x
Och värdet på X är 2, så reaktionen är andra ordningen i förhållande till reagenset till.
Slutgiltighet
Sedan kan värdet på hastighetskonstanten baserat på någon av reaktionerna fastställas:
Reaktionshastighet = k · [a]2· [B]
Tillräckligt för att introducera experimentella värden och rensa k:
K = reaktionshastighet / ([a]2· [B])
Exempel
Följande exempel fungerar som en introduktion innan övningarna löstes från följande avsnitt.
Exempel 1
I en kemisk reaktion:
a) Om den initiala koncentrationen av ett reagens fördubblas reaktionens hastighet: vad är reaktionens ordning med avseende på detta reagens?
b) Om ökningen av reagenskoncentrationen orsakar en ökning av hastigheten i en faktor 8, vad skulle vara reaktionsordningen då?
c) Om koncentrationen av reagenset upplever en förändring och hastigheten förblir densamma: vad är reaktionens ordning med avseende på reagenset?
Det kan tjäna dig: Cycopropane (C3H6)I a) är andelen reaktionshastigheter densamma och andelen reagenskoncentrationer är lika med 2x,
2 = 2x
Därför är x = 1 och reaktionens ordning med avseende på reagenset 1.
I B) är andelen reaktionshastigheten samma 8 (23) och andelen reagenskoncentrationer är lika med 2x,
23 = 2x
Därför är x = 3 och reaktionens ordning med avseende på reagenset 3-
Medan i c) reaktionens hastighet är oberoende av koncentrationen av reagenset, så reaktionens ordning med avseende på reagenset är noll.
Exempel 2
Reaktionen:
2 Nej2 + ANTINGEN2 → 2 Nej2
Det har uttrycket av följande hastighetslag:
Reaktionshastighet = K · [Nej2]2·ANTINGEN2.
Vad är den globala ordningen för reaktionen? Vilka enheter skulle K ha?
Ordningen på reaktionen angående eller2 Det är 1 och ordningen på reaktionen med avseende på inte2 Det är 2, så den globala ordningen för reaktionen är summan av dessa värden, det vill säga 2 + 1 = 3.
Reaktionens hastighet har M/S -enheter, och koncentrationerna av reagensen uttrycks i M. Gör en analys av de enheter vi kommer att ha:
k = reaktionshastighet / ([nej2]2·[ANTINGEN2]
= (M / s) / (m3)
= s-1M-2
Löst övningar
Övning 1
Data för följande reaktion erhölls vid 25 ° C:
A +2 B → C +2 D
Vad är uttrycket för hastighetslagen för denna reaktion? Vad är värdet på din hastighetskonstant?
Beräkningar av reaktionsorder
Experimentella data är:
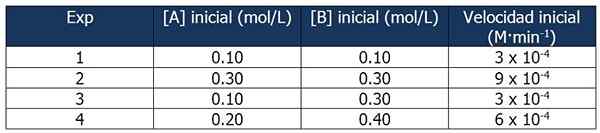 Kinetiska data för övning 1. Källa: Gabriel Bolívar.
Kinetiska data för övning 1. Källa: Gabriel Bolívar. Jämförelsen av experiment 1 och 3 gör att du kan dra följande slutsatser:
Andelen mellan reaktionshastigheterna 3 och 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Men andelen mellan B -koncentrationer är:
(0.3 mol / l) / (0.1 mol/l) = 3
Reaktionens hastighet är oberoende av koncentrationen av B, eftersom dess ökning inte påverkar den. Därför är reaktionens ordning med avseende på reagens B noll.
Å andra sidan tillåter jämförelsen av reaktionerna 4 och 1 följande slutsatser:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Samtidigt är andelen mellan [A] av reaktioner 4 och 1 lika med:
Kan tjäna dig: 5 egenskaper hos homogena blandningar(0.20 mol / l) / (0.10 mol/l) = 2x
Då kommer förhållandet mellan proportionerna att vara:
2 = 2x
x = 1
Därför är uttrycket för hastighetslagen:
Reaktionshastighet = k · [a]
B tas inte in eftersom dess ordning för reaktionen är noll.
Beräkning av k
Vi kan beräkna hastighetskonstanten från någon av de kinetiska data. Låt oss använda experiment 1:
K = reaktionshastighet / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 eller 0.003 min-1
Övning 2
Reaktionshastighetsdata erhölls vid en viss temperatur.
2 Clo2 (AC) +2 OH- (AC) → CLO3- (AC) +CLO2 (Ac) +h2Eller (l)
Beräkningar av reaktionsorder
Experimentella data är:
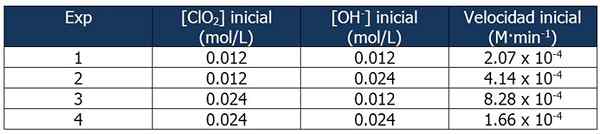 Cinetic Data om övning 2. Källa: Gabriel Bolívar.
Cinetic Data om övning 2. Källa: Gabriel Bolívar. Andelen mellan hastigheterna för reaktion 2 och reaktion 1 är:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
Och andelen OH -koncentrationer- Mellan reaktionerna är 2 och 1 lika med:
(0,024 mol/l)/(0,012 mol/l) = 2x
Exponenten 'X' representerar reaktionens ordning med avseende på OH -reagenset-. Förhållandet mellan beräknade proportioner kan representeras enligt följande:
2 = 2x
x = 1
Därför ordningen på reaktionen med avseende på OH -reagenset- är lika med 1.
I reaktion 3 fördubblas koncentrationen av CLO2 av reaktion 1, medan koncentrationen av OH- Förblir konstant.
Andelen mellan reaktionshastigheterna 3 och 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
Och andelen [CLO2] Mellan reaktionerna 3 och 1 är lika med:
(0,024 mol/l)/(0,012 mol/l) = 2och
Exponenten 'och' representerar reaktionens ordning angående CLO -reagenset2.
Jämför proportionerna:
22 = 2och
4 = 2och
y = 2
Därför är reaktionen tvåa med avseende på CLO -reagenset2.
Uttrycket av hastighetslagen kommer då att vara:
Reaktionshastighet = k · [CLO2]2· [Åh-]
Beräkning av k
Återigen kan vi beräkna K från det föregående uttrycket med någon av de kinetiska data för experimenten. Vi kommer att använda experiment 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 min-1· M-2
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Wikipedia. (2020). Reaktionshastighetskonstant. Hämtad från: i.Wikipedia.org
- Kemi Texas A&M University. (s.F.). Kinetik: beräkningshastighetsberäkningar. Återhämtad från: kem.tamu.Edu
- Keith J. Lidare. (2020). Reaktionshastighet. Britannica Encyclopaedia. Återhämtat sig från: Britannica.com
- Helmestine, Anne Marie, PH.D. (25 augusti 2020). Vad är hastighetskonstanten i kemi? Återhämtat sig från: tankco.com
- Clark Jim. (2013). Hastighetskonstanter och Arrhenius -ekvationen. Återhämtat sig från: Chemguide.co.Storbritannien

