Coulombimetry Fundamentals, typer, applikationer

- 687
- 26
- Lars Eriksson
De Coulombimetri Det är en elektrokemisk analysteknik som består av att utföra en uttömmande elektrolys, så att analyt kan kvantifieras; Det vill säga för att bestämma koncentrationen av analyt i problemen problem genom dess fullständiga oxidation eller reduktion. Det är, till skillnad från potentiometri, en dynamisk teknik, eftersom strömmen får flyta fritt genom elektrokemiska celler.
Som namnet antyder mäts och korreleras den elektriska laddningen Q, i Coulomb -enheter, C, med koncentrationen av den oxiderade eller reducerade analyt i elektrodsperiferierna. Därför är oxidationstillstånd för analytförändringen, som förekommer i processen en överföring och absorption av elektronerna som möjliggör den stökiometriska beräkningen av den önskade koncentrationen.
 Rudimentär montering för en elektrolys där flera färgglada arter bildas på grund av pH och komplexationen av skogarna närvarande. Källa: Steve Jurvetson från Menlo Park, USA, CC av 2.0, via Wikimedia Commons
Rudimentär montering för en elektrolys där flera färgglada arter bildas på grund av pH och komplexationen av skogarna närvarande. Källa: Steve Jurvetson från Menlo Park, USA, CC av 2.0, via Wikimedia Commons I coulombimetri används ett batteri eller potentiostat för att styra den nuvarande eller potential som appliceras på celler. Dessa celler, till skillnad från potentiometriska, består av ett tre -elektrodsystem och är utrustade med en voltmeter och en ammeter.
Coulombimetry ger fördelen att kunna utföra grader utan att förbereda eller standardisera mönster. Det tillåter också kvantifiering av mycket små och begränsade mängder analyt, såsom metallkationer, oorganiska föreningar och organiska föreningar. Till exempel finns det en coulometer utformad uteslutande för att mäta CO2 upplöst i prover från havet.
Denna teknik erbjuder en annan analytisk väg än volymetrisk och potentiometrisk, så många analyser, beroende på analytens elektrokemiska natur, kan utveckla coulombimetriskt.
Teoretiska grunder för coulombimetri
Faraday Law
Coulombimetry är baserad på Faradays lag, som skapar ett samband mellan den elektriska laddningen av en elektrokemisk cell och mängden analyt som oxiderar eller minskar. Att känna till denna belastning Q, liksom belastningen på en elektron (1.6 · 10-19 C), du kan beräkna antalet elektroner som är involverade i en reaktion, noch-:
noch- = Q/E
Å andra sidan är det känt att en mol av elektroner (6.02 · 1023) Porta en elektrisk laddning lika med 96485 C, en siffra känd som Faraday Constant:
F = inTILL
= 96485.3365 c/mol
Att vara bekväm att uttrycka mängden elektroner beroende på mullvad. Tack vare detta kan de stökiometriska koefficienterna för en elektrokemisk reaktion användas, vara oxidation eller reduktion, med hänsyn till hur många mol elektroner som vinner eller förlorar arten.
Kan tjäna dig: natriumfosfat: struktur, egenskaper, syntes, användningGrundläggande beräkningar
Tänk till exempel på följande kemiska ekvation:
Ox + 2e- → Nätverk
Att mäta att när hela oxarten har reducerats till ett nätverk kan vi beräkna mullvad med oxe med omvandlingsfaktorer:
xq · (mol e- /96485.3365 c) · (mol ox/ 2 mol e-) = mol ox
Det vill säga, som vi känner till den elektriska laddningen för en mol av elektroner, kommer vi att ha hur många elektroner som motsvarar lasten XQ. Men i sin tur används varje 2 mol av dessa elektroner för att oxidera 1 mol ox.
Detta resonemang orsakar en direkt formel, även om den inte rekommenderas att memorera den, utan att kunna härleda det som det gjordes:
n = Q/(fñoch-)
Var ñoch- Det är antalet mol elektroner i den kemiska ekvationen.
Under förutsättning att det kan beräknas q, oavsett typ av coulombimetri, kan molen för oxen eller nätverksanalyt bestämmas; Så länge är strömens effektivitet 100%. Det senare innebär att all belastning som måste vara produkten av endast en omvandling, utan att andra arter reduceras eller oxideras.
Experimentella grunder för coulombimetri
Celler
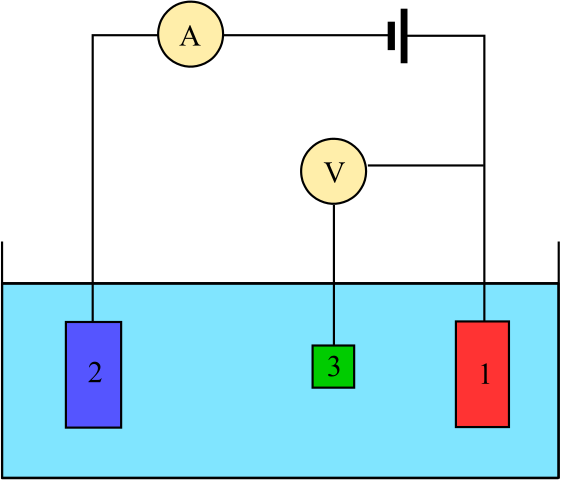 Diagram för en elektrokemisk cell som består av tre elektroder: referensen (3), assistenten (2) och arbetet (1). Källa: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons
Diagram för en elektrokemisk cell som består av tre elektroder: referensen (3), assistenten (2) och arbetet (1). Källa: Adam Rędzikowski, CC BY-SA 3.0, via Wikimedia Commons Up har vi ett diagram för en cell med tre elektroder, som vanligtvis används i coulombimetriska analyser. Redox -reaktionen sker bland arbetselektroder (1) och hjälp (2). Bland dem är två anslutna batteriet, för att applicera potentialen på cellen och ammetern (a) för att mäta de elektriska strömmarna.
Emellertid behövs en referenselektrod (3) för att kunna övervaka potentialen i arbetselektroden och därmed veta variationen i potentialen för hjälpelektroden. På detta sätt kan potentialen för hela cellen bestämmas ochcell, nödvändigt för att uppskatta slutet på redoxreaktionerna i en av typerna av coulombimetri.
Observera att mellan arbetselektroden och referenselektroden nästan inte flyter ström på grund av den höga impedansvoltmetern (V), tack vare vilken det finns en läsning av potentialen för arbetselektroden. Mellan dessa två elektroder har vi ett system som liknar det för en potentiometrisk analys: det är statiskt och inte dynamiskt.
Det kan tjäna dig: kärnkemi: historia, studieområde, områden, applikationerPotential
Coulombimetry är, så att säga, en elektrolys som utförs för analytiska och kvantitativa syften. Därför talas det om att tillämpa externa potentialer, levererade av ett batteri, för att utföra icke -spontana elektrokemiska reaktioner; det vill säga de som har negativa potentialer.
Tänk till exempel på följande reaktioner åtföljda av deras respektive potentiella standarder:
Cu2+ + 2e- ⇌ CU (S) Eºrutnät = +0.337 v
H2Eller ⇌ 1/2o2(g) + 2h+ + 2e- Eºrutnät = +1.230 v
Att vara ekvationen för den globala reaktionen som är lika med:
Cu2+ + H2Eller ⇌ cu (s) + 1/2o2(g) + 2h+ Eºrutnät = -0.893 v
Batteriet måste tillämpa en potential på 0.893 V så att kopparelektrod och bildning av vätejoner är möjlig. Denna potential är Ecell. I praktiken måste emellertid en potentiell större än beräknad tillämpas, eftersom det finns potentialer som motsätter sig utvecklingen av reaktionen:
OCHcell = Ekatod - OCHanod - OP - IR - CP
Var,
OP: överpotential (kinetisk barriär)
IR: Ohmic (inneboende potential för celler)
CP: Polarisering av koncentrationer (produkten av minskningarna i CU2+)
Typer av coulombimetry
Det finns tre typer av coulombimetri: amperostatisk, potentiostatisk och elektrografisk elektrogravimetrisk.
Amperostatisk eller galvanostatisk
I denna typ av coulombimetri är strömmen som går genom cellen konstant genom att använda en amperostat. Därför har strömmen Yo Tack vare läsningen av ammetern och också att veta tiden t När elektrolysen är slut kan vi beräkna belastningen som är associerad med omvandlingen av analyt:
Q = Artikel
En konsekvens av att hålla strömkonstanten är att elektroderna potentiella förändringar, antingen positivt eller negativt. Denna plötsliga variation indikerar att analyten helt har reagerat, vilket är när elektrolysen stannar och mäts t. Detta är grunden för coulometriska grader.
Om potentialen fortsätter eller laddas upp kommer andra oönskade elektroaktiva arter att reagera. Det är därför de potentialer som är förknippade med intresseomvandlingarna bör vara kända perfekt.
Potentatisk
Ett sätt att förhindra andra arter. Det är här där potentiosotisk coulombimetri kommer in, eftersom den använder en potentiostet för att ställa in en viss potential för cellen. Till skillnad från amperostatisk coulombimetri är det nu strömmen som förändras när tiden sker.
Kan tjäna dig: toluen: struktur, egenskaper, användningar, erhållningPå grund av denna tekniska konfiguration kan vi inte beräkna det direkt med värdena Yo och t; Den nuvarande minskar över tiden. Detta beror på att när analyten reagerar kommer det att finnas mindre och färre molekyler eller atomer som donerar eller accepterar elektroner. Därför är det lika med ett integrerat område under grafikkurvan Yo mot t.
Elektronisk
Elektrografisk coulombimetri, helt enkelt känd som elektrogravimetri, är en elektrolys där det inte är nödvändigt att mäta belastningar eller elektriska strömmar. Istället mäts massorna av elektroderna före och efter elektrolys.
Denna teknik gäller endast när arten som reduceras är metallkatjoner som är elektrodepos på elektroderna, vilket gör dem tyngre.
Ansökningar
Potentiostetisk
Potentiostetiska analyser gör det möjligt att minska eller oxidera selektivt en art åt gången mitt i en blandning. Till exempel används de för att bestämma koncentrationen av följande oorganiska joner i spårmängder eller i komplexa matriser:
-Cu2+
-Ess3+
-CD2+
-Co2+
-Tro2+ och tro3+
-Pb2+
-X (f-, Kli-, Bras- och jag-)
-Varken2+
-Pu3+
-Ag+
-Sn2+
-Zn2+
-ELLER6+
Dessa analyser kan också användas för att bestämma sammansättningen av en legering. När syratlegeringen är upplöst appliceras cellpotentialer på ett förskjutet och kontrollerat sätt, vilket bestämmer den reducerade mängden för varje metallkation som integrerar den.
Coulometriska grader
I coulometriska grader används medierande medel som ser till att helt neutralisera eller reagera med den återstående analyten. Syftet med detta är att förhindra potentiella variationer, till en konstant ström, härleder i säkerhetsreaktioner. Således är det möjligt innehavare, till exempel askorbinsyra med jod som mediator.
Vissa metallkatjoner, till exempel Ag+, Ec3+, Tro3+, Mn2+, Du3+, Cr2+, De kan också bestämmas av dessa grader.
Å andra sidan kan syrabasreaktioner fortfarande använda denna teknik, eftersom stora potentialer får vatten att vara joniska3ANTINGEN+ eller åh-, som tjänar från titelagenter som genereras in situ; det vill säga de kommer att neutralisera syrorna eller de närvarande baserna.
Kompaniet2 av havet är nederbördsreaktionerna och bildningen av komplex med EDTA också möjliga att analysera dem genom att applicera coulometriska grader, där redoxindikatorer läggs till för att belysa den slutliga elektrolysen.
Referenser
- Dag, r., & Underwood, a. (1986). Kvantitativ analytisk kemi (Femte ed.). Pearson Prentice Hall.
- Skoog d.TILL., West D.M. (1986). Instrumentalanalys. (Second ED.). Mellanamerikansk., Mexiko.
- Doktor. Doug Stewart. (2020). Definition av coulometri. Återhämtat sig från: Chemicool.com
- Wikipedia. (2020). Coulometri. Hämtad från: i.Wikipedia.org
- Harvey David. (5 juni 2019). Coulometriska metoder. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- « Metodologiska ramar hur man skriver det, struktur, exempel
- Samtida filosofi ursprung, egenskaper, strömmar, författare »

