Bowman kapselstruktur, histologi, funktioner
- 2479
- 433
- Erik Eriksson
De Bowlkapsel Det representerar det initiala segmentet av den rörformiga komponenten i nefronen, Anátomo-funktionell enhet i njurarna där processerna avsedda för urinproduktion utförs och med vilken njuren bidrar till bevarande av organismen Homeostasis.
Det namngavs till hedern för den engelska oftalmologen och anatomisten Doctor Sir William Bowman, som upptäckte dess existens och publicerar sin histologiska beskrivning för första gången 1842.
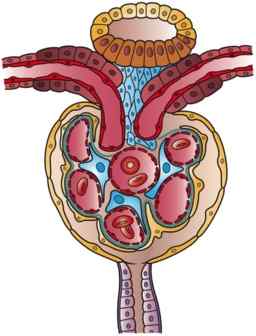
 Illustration av en nefron (källa: konstverk av Holly Fischer [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] via Wikimedia Commons)
Illustration av en nefron (källa: konstverk av Holly Fischer [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] via Wikimedia Commons) Det finns en viss förvirring i litteraturen i förhållande till nomenklaturen för de första segmenten av nefronen, bland vilka Bowman -kapseln ingår. Ibland beskrivs det som en annan del av glomerulus och utgör med den njurkorpuskeln, medan den för andra har en funktion som medlem i glomerulus.
Oavsett det faktum att kapseln i de anatomiska beskrivningarna är en del av glomerulus, är faktumet att båda elementen är så intimt associerade i dess struktur och funktion, att termen glomerulus vaknar i som tänker på idén om en sfärit med dess fartyg.
Om inte, skulle kapseln helt enkelt vara en behållare där vätskan filtreras in i glomerulus hälls, men den skulle inte ha en del i samma glomerulära filtreringsprocess. Vilket inte är så, eftersom hon, som framgår, är en del av den process som hon bidrar på ett speciellt sätt.
[TOC]
Struktur och histologi
Bowmans kapsel är som en liten sfär vars vägg invagineras i den vaskulära sektorn. I denna invagination penetreras kapseln av håret mellanmål, som härstammar i den afferenta arteriola och som ger blod till glomerulus, där den eferenta arteriola som tar blodet från glomerulus också ut kommer ut.
Den motsatta änden av kapseln, kallad urinpol, presenteras som om sfärens vägg hade ett hål till vilket slutet av det första segmentet som börjar själva rörfunktionen, det vill säga den proximala konturerade tubulen är ansluten.
Denna yttre vägg i kapseln är ett platt epitel och kallas Bowman -kapselens parietalepitel. Ändra struktur när man gör övergången till epitel i den proximala tubuli i urinpolen och mot visceralt epitel i den vaskulära polen.
Kan tjäna dig: fungiform papillerDet invagged epitelet kallas visceral eftersom den lindar de glomerulära kapillärerna som om de var en inviskera. Det bildas av celler som kallas podocyter som omfamnar, som täcker dem, till kapillärerna och som har mycket speciella egenskaper.
Podocyterna är organiserade i ett enda lager, avger förlängningar som är sammanhängande med förlängningarna av angränsande podocyter, vilket lämnar utrymmen mellan dem som kallas porer i klyftor eller filtreringsslitsar och som är kontinuitetslösningar för filtreringssteget.
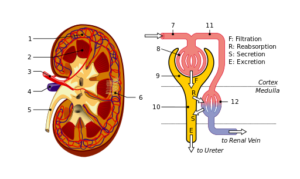 Njur- och nefronstruktur: 1. Njurbark; 2. Märg; 3. Njurartär; 4. Njurvener; 5. Urinledare; 6. Nefroner; 7. Afferent arteriola; 8. Glomerulus; 9. Bowman -kapsel; 10. Tubules och Hanle do; elva. Peritubulära kapillärer (källa: Fil: Fysiologi_of_Nephron.SVG: Madhero88File: KidneysRurtures_Piom.SVG: Piotr Michał Jaworski; Piom i plderivativ arbete: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons)
Njur- och nefronstruktur: 1. Njurbark; 2. Märg; 3. Njurartär; 4. Njurvener; 5. Urinledare; 6. Nefroner; 7. Afferent arteriola; 8. Glomerulus; 9. Bowman -kapsel; 10. Tubules och Hanle do; elva. Peritubulära kapillärer (källa: Fil: Fysiologi_of_Nephron.SVG: Madhero88File: KidneysRurtures_Piom.SVG: Piotr Michał Jaworski; Piom i plderivativ arbete: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] via Wikimedia Commons) Podocyter och endotelceller som täcker ett basmembran på vilket de stöder och har också kontinuitetslösningar för passering av vatten och ämnen. Endotelceller är fenestrador och tillåter också filtrering.
Så dessa tre element: kapillärendotel, basmembran och visceralt epitel i Bowman -kapseln utgör tillsammans membranet eller filtreringsbarriären.
Funktioner
Kapseln är associerad med glomerulär filtreringsprocess. Å ena sidan, eftersom det är en del av epitelhöljet av podocyter som omger de glomerulära kapillärerna. Det bidrar också syntesen av basmembranet på vilket detta epitel och det glomerulära kapillärendotelet stöds.
Dessa tre strukturer: kapillärendotel, basmembran och visceralt epitel i Bowman -kapseln utgör det så kallade membranet eller filtreringsbarriären, och var och en av dem har sina egna permeabilitetsegenskaper som bidrar till den globala selektiviteten för den barriären.
Dessutom bestämmer vätskevolymen som tränger in i Bowman -utrymmet, tillsammans med den grad av styvhet som den kapseliga yttre väggen motsätter sig, uppkomsten av ett intracapsulärt tryck som hjälper till att modulera det effektiva filtreringstrycket och öka vätskan i hela den tillhörande tubuli.
Kan tjäna dig: periosteum: egenskaper, funktioner och histologiDeterminanter av storleken på glomerulär filtrering
En variabel som samlar storleken på glomerulär filtreringsprocess är den så kallade glomerulära filtreringsvolymen (VFG), som är volymen vätska som filtreras i alla glomeruli i tidsenheten. Det genomsnittliga normala värdet är cirka 125 ml/min eller 180 L/dag.
Storleken på denna variabel bestäms ur den fysiska synvinkeln av två faktorer, nämligen den SO -kallade filtrering eller ultrafiltrering (KF) och det effektiva filtreringstrycket (PEFF). Det är: VFG = KF X PEFF (Ekvation 1)
Filtreringskoefficient (KF)
Filtreringskoefficienten (KF) är produkten av hydraulisk konduktivitet (LP), som mäter vattenpermeabiliteten för ett membran i ml/min per enhetsenhet och implementeringsenhet, med ytarean (a) på filtermembranet, Det vill säga KF = LP X A (Ekvation 2).
Filtreringskoefficientens storlek indikerar vätskevolymen som filtreras per tidsenhet och per effektiv enhet. Även om det är mycket svårt att mäta direkt, kan det erhållas från ekvation 1 och dela VFG/PEFF.
KF i de glomerulära kapillärerna är 12,5 ml/min/mmHg per c/100 g vävnad, värde cirka 400 gånger högre än KF för andra kapillarsystem i kroppen, där du kan filtrera cirka 0,01 ml/min/mm Hg per 100 g tyg. Jämförelse som visar glomerulär filtreringseffektivitet.
Effektivt filtreringstryck (PEFF)
Det effektiva filtreringstrycket representerar resultatet av den algebraiska summan av de olika tryckkrafterna som gynnar eller motsätter sig filtrering. Det finns en hydrostatisk tryckgradient (ΔP) och ett annat osmotiskt tryck (onkotisk, Δп) bestämd av närvaron av proteiner i plasma.
Den hydrostatiska tryckgradienten är tryckskillnaden mellan insidan av glomerulär kapillär (PCG = 50 mm Hg) och Bowman -kapselutrymmet (PCB = 12 mm Hg). Som man ser är denna lutning riktad från kapillären till kapseln och främjar förskjutningen av vätska i detta avseende.
Kan tjäna dig: Appendicular Skeleton: Funktioner och benDen osmotiska tryckgradienten rör sig vätskan mindre till högre osmotiskt tryck. Endast partiklar som inte filtrerar utövar denna effekt. Proteiner filtrerar inte. Dess пcb är 0 och i пcg glomerulär kapillär är den 20 mm Hg. Denna lutning flyttar vätska från kapseln till kapillären.
Det effektiva trycket kan beräknas genom att applicera PEFF = ΔP-Δп; = (PCG-PCB)-(пcg-пcb); = (50-12)-(20-0); = 38-20 = 18 mm Hg. Det finns därför ett effektivt eller nettofiltreringstryck på cirka 18 mm Hg som bestämmer en VFG på cirka 125 ml/min.
Filtreringsindex (IF) av de ämnen som finns i plasma
Det är en indikator på enkelheten (eller svårigheten) som ett ämne som finns i plasma kan korsa filtreringsbarriären. Indexet erhålls genom att dela koncentrationen av ämnet i filtrering (FX) mellan dess koncentration i plasma (Px), det vill säga: IFX = FX/ PX.
Om värden är mellan maximalt 1 för de ämnen som filtrerar fritt och 0 för de som inte filtrerar något. Mellanvärden är för partiklar med mellanproblem. Ju närmare 1 värdet, desto bättre filtrering. Närmare 0, svårare att filtrera.
En av de faktorer som bestämmer om är partikelns storlek. De som har diametrar mindre än 4 nm filter fritt (om = 1). När storleken växer och närmar sig albumin reduceras Fe. Albuminstorlekspartiklar, eller större, har 0 IFS på 0.
En annan faktor som hjälper till att bestämma IF är negativa elektriska belastningar på molekylytan. Proteiner har mycket negativ belastning, som läggs till i deras storlek för att hindra deras filtribilitet. Anledningen är att porer har negativa laddningar som avvisar proteiner.
Referenser
- Ganong WF: njurfunktion och micturition, i Granskning av medicinsk fysiologi, 25: e upplagan. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Urinsystemet, i Lärobok för medicinsk fysiologi , 13: e upplagan, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, i Physiologie des Menschen Mite Pathophysiologie, 31 ED, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: die funkction der nieren, i Fysiologi, 6: e upplagan; R KLINKE et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl Rak et al: Niere Undoitende Harnwege, i Klinche patofysiologie, 8: e upplagan, W Siegenthaler (ed). Stuttgart, Georg Thieme Verlag, 2001.
- « Vad är fibrösa leder? Typer och egenskaper
- Baragonnosia ursprung, koncept, test, relaterade störningar »

