Darmstadtio upptäckt, struktur, egenskaper, användningar

- 1078
- 51
- Anders Svensson
han Darmstadtio Det är ett ultratungt kemiskt element som ligger i Transactinid -serien, som börjar strax efter Lawrencio Metal. Det är specifikt i grupp 10 och period 7 i det periodiska tabellen, som är kongener för nickel-, paladium- och platinametallerna.
Den har en kemisk symbol med ett atomantal på 110, och dess mycket få atomer som har syntetiserats är praktiskt taget sönderdelade direkt. Det är därför ett flyktigt element. Syntetisera och upptäcka att den representerade en prestation på 90 -talet av förra seklet och tog krediten för sin upptäckt en grupp tyska forskare.
 Darmstadtioelementet upptäcktes vid German Institute GSI, i staden Darmstadt. Källa: Commander-Pirx på German Wikipedia [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Darmstadtioelementet upptäcktes vid German Institute GSI, i staden Darmstadt. Källa: Commander-Pirx på German Wikipedia [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Innan hans upptäckt och att det diskuterades vad hans namn skulle vara, hade IUPAC-nomenklaturen formellt namngivit 'Unaunilio', vilket betyder 'en-en-noll', lika med 110. Och längre bakom denna nomenklatur, enligt Mendeleev-systemet, var namnet Eka-Platino för kemiskt tänkande på denna metall.
Darmstadtio är ett element som inte bara är flyktigt och instabilt, utan också mycket radioaktivt, i vars kärnkraft förfaller de flesta av dess isotoper släpper Alfas -partiklar; Dessa är, helio nakna kärnor.
På grund av dess flyktiga liv uppskattas alla dess egenskaper och kan aldrig användas för något särskilt syfte.
[TOC]
Upptäckt
Tysk meriter
Problemet kring upptäckten av Darmstadtio var att flera forskare hade ägnat sig åt sin syntes under på varandra följande år. Så snart dess atom bildades bleknade den i bestrålade partiklar.
Därför kunde det inte famlat vilka av lagen som förtjänade krediten att ha syntetiserat först, när till och med upptäckt det redan representerade en utmaning och minskade så snabbt och släppte radioaktiva produkter.
Det kan tjäna dig: Taninsyra: struktur, egenskaper, erhållning, användningI syntesen av Darmstadtio arbetade de av separata team från följande utredningscentra: Central Institute of Nuclear Research i Dubná (då Sovjetunionen), Lawrence Berkeley National Laboratory (USA) och Heavy Ion Research Center (förkortat på tyska som GSI) ).
GSI ligger i den tyska staden Darmstadt, där de i november 1994 syntetiserade den radioaktiva isotopen 269Ds. De andra lagen syntetiserade andra isotoper: 267DS i ICIN, och 273Ds i LNLB; Dess resultat hade emellertid inte varit avgörande i de kritiska ögonen på IUPAC.
Varje team hade föreslagit ett visst namn för detta nya element: Hahnio (ICIN) och Deselio (LNLB). Men efter en IUPAC -rapport 2001 hade det tyska GSI -teamet rätt att utse elementet som Darmstadtio.
Syntes
Darmstadtio är en produkt av sammansmältningen av metallatomer. Som? I princip, en relativt tung som fungerar som vit eller mål, och ett annat ljus som kommer att kollideras mot den första med en hastighet som är lika med den tionde av ljusets hastighet i ett vakuum; Annars kunde avvisningarna mellan dess två kärnor inte övervinnas.
När de två kärnorna kolliderar effektivt kommer en kärnfusionsreaktion att inträffa. Protoner går med, men neutronernas öde är annorlunda. Till exempel utvecklade GSI följande kärnreaktion, av vilken den första atomen inträffade 269DS:
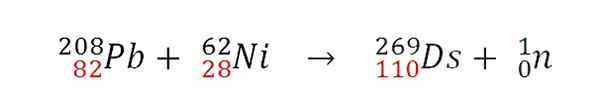 Kärnkraftsreaktion för syntesen av en isotopatom 269DS. Källa: Gabriel Bolívar.
Kärnkraftsreaktion för syntesen av en isotopatom 269DS. Källa: Gabriel Bolívar. Observera att protonerna (i rött) läggs till. Varierande atommassorna av de kolliderade atomerna erhålls olika isotoper av Darmstadtio. I själva verket gjorde GSI experiment med isotopen 64Inte heller istället för 62Inte heller av dem som bara syntetiserade 9 atomer av isotopen 271Ds.
Kan tjäna dig: aldehydosGSI lyckades skapa 3 atomer av 269DS, men efter att ha avrättat tre biljoner bombningar per sekund under en hel vecka. Dessa data erbjuder ett överväldigande perspektiv av dimensionerna av sådana experiment.
Darmstadtiostruktur
Eftersom endast en darmstadtioatom per vecka kan syntetiseras eller skapas, är det osannolikt att det har tillräckligt för att etablera en kristall; För att inte nämna att den mest stabila isotopen är 281DS, vars t1/2 Det är bara 12,7 sekunder.
För att bestämma deras kristallina struktur är forskare baserade på beräkningar och uppskattningar som försöker närma sig det mest verkliga panoramaet. Således har det uppskattats att strukturen för Darmstadtio är kubikcentrerad på kroppen (BCC); Till skillnad från de av deras mest lätta nickel, paladium och platina kongener, med kubiska strukturer centrerade på ansikten (FCC).
I teorin måste de yttersta elektronerna i Orbitals 6D och 7s delta i sin metalliska länk, enligt deras uppskattade elektroniska konfiguration:
[Rn] 5f146d87s2
Men det blir förmodligen känt experimentellt från de fysiska egenskaperna hos denna metall.
Egenskaper

De andra egenskaperna hos Darmstadtio uppskattas också av samma skäl som nämns för dess struktur. Vissa av dessa uppskattningar är dock intressanta. Till exempel skulle Darmstadtio vara en ännu mer ädel metall än guld, liksom mycket tät (34,8 g/cm3) att osmium (22,59 g/cm3) och El Mercurio (13,6 g/cm3).
När det gäller dess möjliga oxidationstillstånd har det uppskattats att det skulle vara +6 (DS6+), +4 (DS4+) och +2 (DS2+), lika med deras lättare kamrater. Därför, om atomerna i 281DS innan de sönderdelas skulle föreningar som DSF erhållas6 eller dscl4.
Det kan tjäna dig: 50 exempel på syror och baserÖverraskande finns det sannolikheten för att syntetisera dessa föreningar, eftersom 12,7 sekunder, t1/2 av 281DS, det är mer än tillräckligt med tid att göra reaktioner. Emellertid fortsätter besväret att med bara en atom av DS i veckan är det otillräckligt att samla in alla data som krävs av en statistisk analys.
Ansökningar
Återigen, eftersom det är en sådan knapp metall, som för närvarande syntetiseras i atomiska och inte massiva mängder, är det ingen nytta för honom; Inte ens i den avlägsna framtiden.
Om inte en metod för att stabilisera sina radioaktiva isotoper, kommer Darmstadtio -atomer bara att användas för att väcka vetenskaplig nyfikenhet, särskilt när det gäller kärnfysik och kemi.
Men om något sätt att skapa dem i rikliga mängder hanteras, kommer fler ljus att kastas på kemin i detta ultralat tunga och flyktiga element.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Darmstadium. Hämtad från: i.Wikipedia.org
- Steve Gagnon. (s.F.). Elementet darmstadium. Jefferson Lab Resource. Återhämtat sig från: utbildning.Jlab.org
- Nationellt centrum för bioteknikinformation. (2020). Darmstadium. Pubchemdatabas. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Brian Clegg. (15 december 2019). Darmstadium. Kemi i sina element. Återhämtat sig från: Chemistryworld.com
- « Oxidationsnummerkoncept, hur man får ut det och exempel
- Molmassa hur det beräknas, exempel och övningar löst »

