Halogenerade derivat

- 1739
- 485
- PhD. Emil Svensson
Vi förklarar vad de halogenerade derivaten, deras egenskaper, användningar/applikationer är och vi ger flera exempel
Vad är halogenerade derivat?
De halogenerade derivat De är alla föreningar som har en halogenatom; Det vill säga någon av elementen i grupp 17 (F, CL, BR, I). Dessa element skiljer sig från resten eftersom de är mer elektronegativa och bildar en mångfald av oorganiska och organiska halogenider.
Den nedre bilden av halogener visas i den nedre bilden. Från topp till botten: fluorid (f2), Klor (CL2), Bromo (br2) och jod (i2). Var och en av dessa har förmågan att reagera med den stora majoriteten av elementen, inklusive mellan kongener i samma grupp (interhalogener).

Således har halogenerade derivat en MX -formel om det är en metallhaluro, Rx om den är alkyl och ARX om den är aromatisk. De två sista finns i kategorin Organiska Haluros. Stabiliteten hos dessa föreningar kräver en energi "fördel" framför den ursprungliga läskmolekylen.
Som en allmän regel bildar fluoriden halogenerad mer stabil än jod. Anledningen beror på skillnaderna mellan deras atomradio (de lila sfärerna är mer skrymmande än de gula).
Genom att öka atomradie är överlappningen av orbitalerna mellan halogenen och den andra atomen sämre och därför är länken svagare.
Nomenklatur
Sättet att korrekt namnge dessa föreningar beror på om de är oorganiska eller organiska.
Oorganisk
Metalliska halogenider består av en bindning, jonisk eller kovalent, mellan en halogen X och en M -metall (av grupperna 1 och 2, övergångsmetaller, tungmetaller, etc.).
I dessa föreningar har alla halogener ett oxidationstillstånd på -1. Därför att? Eftersom dess Valencia -konfigurationer är NS2Np5.
Därför måste de bara vinna en elektron för att slutföra Octet of Valencia, medan metallerna oxiderar, vilket ger dem de elektroner de har.
Kan tjäna dig: Precision Balance: Egenskaper, funktioner, delar, användningarSåledes förblir fluor som f-, fluorid; Cl-, klorid; br-, bromid; och jag-, jag varar. MF skulle namnges: fluorid av (metallnamn) (n), som är n Valencia del metall endast när den har mer än en. När det gäller grupper av grupper 1 och 2 är det inte nödvändigt att namnge Valencia.
Exempel
- NAF: natriumfluorid.
- CaCl2: kalciumklorid.
- AGBR: Silverbromid.
- Zni2: Zink yoduro.
- CUCL: Kopparklorid (I).
- CuCl2: kopparklorid (ii).
- TiCl4: Titanklorid (iv) eller titano tetraklorid.
Väte- och icke -metallelement - även samma halogener - kan emellertid också bilda haluros. I dessa fall utses inte Valencia för No Metal i slutet:
- Pcl5: fosfor pentaklorid.
- Bf3: Boro Trifluoruro.
- Ali3: Aluminium triyoduro.
- HBR: vätebromid.
- Om7: jod heptofluorid.
Organisk
Oavsett om RX eller ARX är halogenen kovalent kopplad till en kolatom. I dessa fall nämns halogener av deras namn, och resten av nomenklaturen beror på molekylstrukturen för R eller AR.
För den enklaste organiska molekylen, metan (CHO4), Följande derivat erhålls genom att ersätta H med CL:
- Ch3CL: klormetan.
- Ch2Kli2: diklormetan.
- Chcl3: tricylorometan (kloroform).
- Ccl4: Tetraklormetan (kolklorid (iv) eller koltetraklorid).
Här består r av en enda kolatom. För andra alifatiska kedjor (linjära eller grenar) räknas antalet kolhydrater från vilket det är kopplat till halogen:
Ch3Ch2Ch2F: 1-fluorpropano.
Det föregående exemplet var det av en primär alquilisk halogenid. I händelse av att kedjan är grenad väljs den längsta som innehåller halogenen och börjar räkna, vilket lämnar detta som möjligt nummer:
Kan tjäna dig: Vilka är de fysiska egenskaperna hos materien?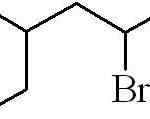
3-metyl-5-bromhexan
På samma sätt som det inträffar för andra substituenter. För de aromatiska halogeniderna utses också halogen och sedan resten av strukturen:

Den överlägsna bilden visar föreningen som kallas bromobensen och markerar bromatomen i brunt.
Egenskaper hos halogenerade derivat
Oorganiska halogenider
Oorganiska halogenider är joniska eller molekylära fasta ämnen, även om de förstnämnda är mer rikliga. Beroende på interaktioner och joniska radioapparater av MX kommer detta att vara lösligt i vatten eller andra mindre polära lösningsmedel.
Icke -metalliska halogenider (som Boro) är vanligtvis Lewis -syror, vilket innebär att de accepterar elektroner för att bilda komplex. Å andra sidan producerar halogenider (eller halogenuros) väte upplöst i vatten vad som kallas hydracider.
Dess smältpunkter, kokning eller sublimering faller på elektrostatiska eller kovalenta interaktioner mellan metall eller icke -metall med halogen.
På samma sätt spelar joniska radioapparater en viktig roll i dessa egenskaper. Till exempel om m+ och x- De har liknande storlekar, deras kristaller kommer att vara mer stabila.
Organiska halogenider
De är polära. Därför att? Eftersom skillnaden i elektronegativiteter mellan C och halogen skapar ett permanent polärt ögonblick i molekylen. Detta minskar också när grupp 17 går ner från C-F-länken till C-I.
Utan att överväga molekylstrukturen för R eller AR påverkar de växande halogenantalet direkt kokpunkterna, eftersom de ökar molmassan och intermolekylära interaktioner (RC-X-X-CR). De flesta är oblandbara med vatten, men de kan upplösas i organiska lösningsmedel.
Användning av halogenerade derivat
Användningen av halogenerade derivat kan reservera sin egen text. De molekylära "följeslagarna" av halogener är en nyckelfaktor, med tanke på att deras egenskaper och reaktiviteter definierar användningen av derivatet.
Kan tjäna dig: kaliumsulfat (K2SO4): Struktur, egenskaper, användningar, syntesSåledes, bland den stora mångfalden av möjliga användningsområden, sticker ut:
- Molekylära halogener används för att skapa halogenlökor, där du kommer i kontakt med den glödande volframtråden. Syftet med denna blandning är att reagera halogen x med den förångade volfram. På detta sätt undviks dess avsättning på ytan av glödlampan, vilket garanterar mer livstid.
- Fluorursalter används vid fluorisering av tandvatten och pastor.
- Natrium- och kalciumhypokloriter är två aktiva medel i kommersiella blekningslösningar (klor).
- Även om de försämrar ozonskiktet används klorfluorkolväten (CFC) i aerosoler och kylsystem.
- Vinylklorid (CHO2= CHCL) är monomeren av polyvinylpolymerkloriden (PVC). Å andra sidan består teflon, som används som icke -stickmaterial, av polymera kedjor av tetrafluoretylen (F2C = cf2).
- De används i analytisk kemi och organisk syntes för olika ändamål; Bland dessa läkemedelssyntes.
Ytterligare exempel

Den överlägsna bilden illustrerar sköldkörtelhormonet, ansvarigt för värmeproduktion såväl som ökningen av allmän metabolism i kroppen. Denna förening är ett exempel på ett halogenerat derivat som finns i människokroppen.
Bland andra halogenerade föreningar nämns följande:
- Diclorodifenilriclorootan (DDT), effektiv insekticid men med allvarliga miljöpåverkan.
- Tinklorid (SNNCL2), används som reducerande agent.
- Kloretan eller 1-kloroetan (CH3Ch2Cl), aktuell bedövningsmedel som fungerar snabbt kyler huden.
- Dikloretylen (CLCH = CCLH) och tetrakloretylen (CL2C = ccl2), används som lösningsmedel inom kemtvättindustrin.
- « Kiliconkarbidkemisk struktur, egenskaper och användningar
- 80 fraser för den första kärleken som aldrig glömmer »

