Protein denaturering Vad är, faktorer, konsekvenser
- 2173
- 30
- Karl Johansson
Vad är denaturering av proteiner?
De protein denaturering Den består av förlusten av tre dimensionell struktur på grund av olika miljöfaktorer, såsom temperatur, pH eller vissa kemiska medel. Förlusten av strukturen resulterar i förlusten av den biologiska funktionen associerad med det proteinet, vare sig enzymatiska, strukturella, transportör, bland andra.
Proteinets struktur är mycket känslig för förändringar. Destabiliseringen av en enda essentiell vätebro kan denaturalisera proteinet. På samma sätt finns det interaktioner som inte är strängt väsentliga för att uppfylla proteinfunktionen, och i fall av destabiliserad har den ingen effekt på driften.
Proteinstruktur
För att förstå protein -denatureringsprocesserna måste vi veta hur proteiner är organiserade. Dessa har primära, sekundära, tertiära och kvartära struktur.
Primärstruktur
Det är aminosyrasekvensen som utgör detta protein. Aminosyror är de grundläggande blocken som utgör dessa biomolekyler och det finns 20 olika typer, var och en med särskilda fysiska och kemiska egenskaper. De går samman med en peptidlänk.
Sekundärstruktur
I denna struktur börjar denna linjära kedja av aminosyror vikas av vätebroar. Det finns två grundläggande sekundära strukturer: a -propellen, spiralformad; och det fällbara bladet ß, när två linjära kedjor är inriktade parallellt.
Tertiärstruktur
Det involverar andra typer av krafter som resulterar i specifik vikning av den tre dimensionella formen.
R -kedjorna av aminosyrarester som utgör strukturen hos proteinet kan bilda disulfidbroar och de hydrofoba delarna av proteinerna grupperas inuti, medan hydrofiliker vetter mot vattnet till vattnet. Van der Waals styrkor fungerar som en stabilisator för de beskrivna interaktionerna.
Kan tjäna dig: isoleucin: egenskaper, funktioner, biosyntes, matKvartärstruktur
Den består av aggregat av proteinenheter.
När ett protein denatureras förlorar det den kvartära, tertiära och sekundära strukturen, medan det primära förblir intakt. Proteiner som är rika på disulfidlänkar (tertiär struktur) ger större denatureringsresistens.
Faktorer som orsakar denaturering
Varje faktor som destabiliserar icke -kovalenta bindningar som är ansvariga för att upprätthålla den ursprungliga strukturen i proteinet kan producera dess denaturering. Bland de viktigaste vi kan nämna:
pH
Vid mycket extrema pH -värden, vare sig sura eller grundläggande medel, kan protein förlora sin tre -dimensionella konfiguration. Överskottet hones h+ och åh- I mitten destabiliserar proteininteraktioner.
Denna förändring av jonmönster ger denaturering. PH -denaturering kan vara reversibel i vissa fall och i andra irreversibla.
Temperatur
Termisk denaturering sker genom att öka temperaturen. I organismer som lever i genomsnittliga miljöförhållanden börjar proteiner destabilisera vid temperaturer större än 40 ° C. Det är uppenbart att termofila organismproteiner kan stödja dessa temperaturintervall.
Temperaturökningar översätts till ökning av molekylära rörelser som påverkar vätebroar och andra icke -kovalenta bindningar, vilket resulterar i förlust av tertiär struktur.
Dessa temperaturökningar leder till reaktionshastighet, om vi pratar om enzymer.
Kemiska substanser
Polära ämnen - såsom urea - i höga koncentrationer påverkar vätebroar. På samma sätt kan icke -polära ämnen få liknande konsekvenser.
Detergenter kan också destabilisera proteinstrukturen; Det är dock inte en aggressiv process och de är mestadels reversibla.
Kan tjäna dig: Tysk kackerlacka: Egenskaper, reproduktion, matReducerande agenter
P-Mercaptoetanol (Hoch2CH2SH) är ofta kemiskt medel i laboratoriet för att denaturalisera proteiner. Det ansvarar för att minska disulfidbroarna mellan aminosyravfall. Kan destabilisera proteinets tertiära eller kvartära struktur.
Ett annat reducerande medel med liknande funktioner är DitiotReitol (DTT). Dessutom är andra faktorer som bidrar till förlusten av nativ struktur i proteiner tungmetaller i höga koncentrationer och ultraviolett strålning.
Konsekvenser av protein denaturering
När denaturaliseringen inträffar förlorar proteinet sin funktion. Proteiner fungerar optimalt när de är i sitt ursprungliga tillstånd.
Förlusten av funktionen är inte alltid associerad med en denatureringsprocess. En liten förändring i proteinstrukturen kan leda till förlust av funktion utan att destabilisera hela det tre dimensionella strukturen.
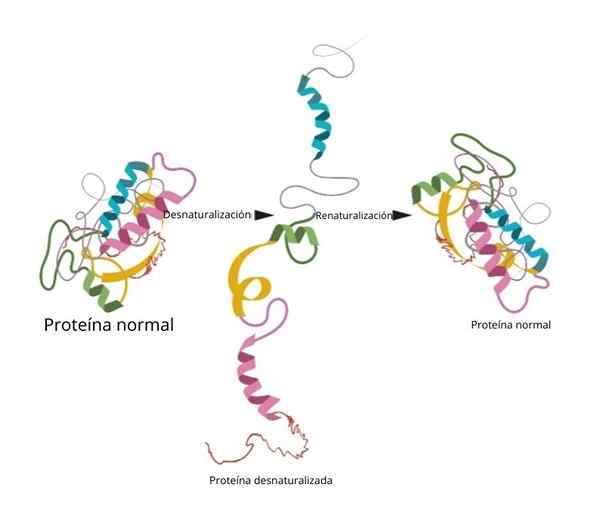
Processen kan eller inte vara irreversibel. I laboratoriet, om förhållandena är omvänd att proteinet återgår till sin initiala konfiguration.
Renaturalisering
Ett av de mest berömda och avgörande experimenten med renaturisering bevisades i ribonukleaset till.
När forskarna tillsatte denaturering av medel som urea eller ß-merkaptanol, denaturerades proteinet. Om dessa medel togs bort, återgick proteinet till sin ursprungliga konformation och kunde utföra sin funktion med 100 % effektivitet.
En av de viktigaste slutsatserna från denna forskning var att experimentellt visa att den tre dimensionella konformationen av proteinet ges av dess primära struktur.
I vissa fall är denaturiseringsprocessen helt irreversibel. Till exempel, när vi lagar ett ägg vi applicerar värme i proteiner (det huvudsakliga är albumin) som utgör det, tar det klara ett fast och vitaktigt utseende. Intuitivt kan dra slutsatsen att även om vi kyler det kommer den inte att återgå till dess ursprungliga form.
Kan tjäna dig: ovogenes: faser, egenskaper hos djur och växterI de flesta fall åtföljs denaturiseringsprocessen av förlust av löslighet. Viskositet, diffusionshastighet reduceras också och kristalliseras lättare.
Chaperonas proteiner
Chaperonas eller chaperoninproteiner ansvarar för att förhindra denaturering av andra proteiner. De förtrycker också vissa interaktioner som inte är tillräckliga bland proteiner för att säkerställa en korrekt vikning av dem.
När mediumtemperaturen ökar ökar dessa proteiner sin koncentration och verkar genom att förhindra denaturering av andra proteiner. Det är därför de också kallas "termiska chockproteiner" eller HSP för dess akronym på engelska (Värmechockproteiner).
Chaperonins är analoga med en bur eller fat som skyddar intresset inuti.
Dessa proteiner som svarar på cellulära stresssituationer har rapporterats i olika grupper av levande organismer och är mycket bevarade. Det finns olika typer av chaperoniner och klassificeras enligt deras molekylvikt.

