Dibenzalacetona -egenskaper, reaktionsmekanism, användningar, risker

- 4621
- 1155
- Per Karlsson
De Dibenzalacetona (Dba) är en organisk förening vars molekylformel är c17H14ANTINGEN. Det är ett gulaktigt fast ämne som beroende på dess renhet kan presenteras som kristaller. Det används i solskyddsmedel och organometal syntes där paladiet används som katalysator.
Medan dess syntes är en relativt enkel, ganska återkommande process för att undervisa laboratorier för att förklara aldolisk kondensation, är dess mekanism lite omfattande, flera faktorer bör beaktas. Benzaldehyden som används, som kommer att kondensera med aceton, måste nyligen destilleras för att garantera dess låga oxidation i kontakt med luften.
 Dibenzalacetona prov i glasbehållare. Källa: Stephanb [CC BY-SA (http: // CreativeCommons.Org/licenser/BY-SA/3.0/]]
Dibenzalacetona prov i glasbehållare. Källa: Stephanb [CC BY-SA (http: // CreativeCommons.Org/licenser/BY-SA/3.0/]] På samma sätt används ett etanol-vattenmedium för att solubilisera reagensen och samtidigt främja den slutliga utfällningen av dibenzalaceton, hydrofob och olöslig sammansättning. Hittills är det inte känt vilka negativa effekter som kan utöva dibenzalaceton på organismen eller miljön, snarare än att vara ett irriterande ämne.
[TOC]
Egenskaper
Fysiskt utseende
Fast gulaktigt dammigt eller kristallint utseende.
Molmassa
234,29 g/mol
Isomerer
Dibenzalaceton presenteras som tre geometriska isomerer: trans-trans-trans-cis och cis-cis. Transtrans-isomeren är den mest stabila och därför den som förekommer mest under syntesen.
Smältpunkt
110-111 ºC. Detta intervall varierar beroende på renhetsgraden för det syntetiserade fasta ämnet.
Vattenlöslighet
Olöslig.
Strukturera
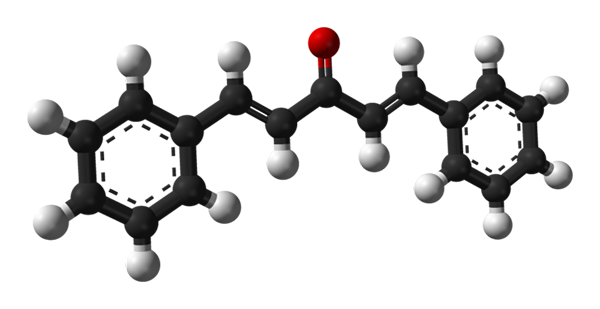 Dibensalacetonens molekylstruktur. Källa: Benjah-Bmm27 [Public Domain]
Dibensalacetonens molekylstruktur. Källa: Benjah-Bmm27 [Public Domain] I den övre bilden visas molekylen i transtrans-trans-isomeren. I mitten av det har vi karbonylgruppen, och på dess sidor, dubbelbindningar och två aromatiska bonenceno -ringar.
Dibenzalaceton är i apolär och hydrofob essens, eftersom hela strukturen är praktiskt taget sammansatt av kol- och väteatomer. Karbonylgruppen ger den bara ett litet dipolmoment.
Kan tjäna dig: aluminium fosfuro (AIP): struktur, egenskaper, användningar, riskerStrukturen kan likställas med ett ark, eftersom alla dess kolatomer har SP -hybridisering2; Därför vilar de i samma plan.
Ljusfotoner interagerar med det konjugerade π -systemet i dibenzalacetona; Särskilt de med UV -strålning, som absorberas för att locka inflyttade elektroner. Den här egenskapen gör Dibenzalacetona till ett utmärkt absorberande av ultraviolett ljus.
Dibenzalacetona reaktionsmekanism
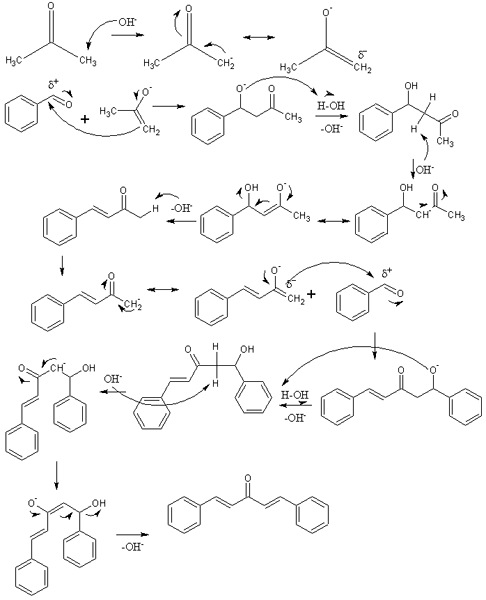 Mekanism för aldolisk kondens i syntesen av Dibenzalacetona. Källa: Izmaelt [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Mekanism för aldolisk kondens i syntesen av Dibenzalacetona. Källa: Izmaelt [CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] I den överlägsna bilden har vi representerat mekanismen för aldolisk kondensation mellan bensaldehyd och aceton för att komma från dibenzalaceton; specifikt dess transtrans isomer.
Reaktionen börjar med aceton i basmedium. ÅH- Avslöja en syraproton av någon av dess två metylgrupper, -ch3, ger upphov till ett inolt: Cho3C (o) ch2-, som flyttar sin negativa resonansbelastning (bildens första rad).
Denna inolt fungerar sedan som ett nukleofilt medel: attackerar karbonylgruppen för en bensaldehydmolekyl. Dess införlivande i bensaldehyden genererar en alkoxid, som eftersom det är mycket grundläggande förödande en vattenmolekyl och blir en aldol (andra raden). Aldol eller ß-hydroxychithon kännetecknas av att ha grupper C = O och OH.
Det grundläggande mediet dehydrater Denna aldol och en dubbelbindning bildas i dess struktur, som genererar bensylidenaceton (tredje raden). Sedan, åh- Också oprotous en av dess sura hydrogener och upprepar en annan nukleofil attack på en andra bensaldehydmolekyl. Den här gången sker attacken så snabbt (fjärde raden).
Produkten bildade oskyddade en annan vattenmolekyl och lider återigen en uttorkning för att eliminera OH -gruppen och etablera en andra dubbelbindning (femte och sjätte rader). Således och slutligen inträffar Dibenzalacetona.
Kan tjäna dig: Boyle LawSyntes
Reagens
Reagensen för att utföra syntesen av dibenzalaceton är följande:
- 95% etanol.
- Nyligen destillerad bensaldehyd av bitter mandelolja.
- NaOH som en grundläggande katalysator i destillerat vatten.
Mängderna som ska användas beror på hur mycket dibenzalaceton den är avsedd att syntetisera. Det finns emellertid ett överskott av bensaldehyd, eftersom en del av den oxideras till bensoesyra. Det är också garanterat att reaktionen tar mindre tid och att den oönskade bensylidenacetonen produceras i mindre utsträckning.
Etanol fungerar som ett lösningsmedel av bensaldehyd, eftersom det annars inte skulle upplösas i den grundläggande miljön i NaOH.
Procedur
I ett stort fällningsglas blandas etanol med bensaldehyd. Sedan tillsätts det grundläggande mediet för NaOH under konstant magnetisk agitation. I detta steg inträffar Cannizzaro -reaktionen; Det vill säga två bensaldehydmolekyler som är oproportionerliga i en av bensylalkohol och en annan av bensoesyra, lätt igenkännande av dess karakteristiska söta lukt.
Slutligen tillsätts aceton och en halvtimme förväntas för att lösningen ska bli molnig och en gul-orange färg. Dibenzalacetona kommer att fälla ut på grund av vatten, så en betydande vattenvolym tillsätts för att främja dess fullständiga nederbörd.
Dibenzalacetona filtrerar in i ett vakuum och dess gulaktiga fasta ämnen var lava flera gånger med destillerat vatten.
Omkristallisation
 Ett omkristalliserat prov av dibenzalacetona måste bära en glans som liknar det för kristallerna i denna bild. Källa: Smokefoot [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0)]
Ett omkristalliserat prov av dibenzalacetona måste bära en glans som liknar det för kristallerna i denna bild. Källa: Smokefoot [CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/4.0)] För att rena dibenzalaceton används 95% etanol eller varm etylacetat, så att mer renhetskristaller erhålls för varje gång omkristallisation upprepas. Således kommer det initiala gulaktiga dammet att förvandlas till små gula kristaller i dibenzalacetona.
Kan tjäna dig: bensoesyra (C6H5COOH)Ansökningar
Dibenzalacetona är en förening som inte har för många användningsområden. På grund av dess förmåga att absorbera ultraviolett ljus används det i formuleringen av solskyddsmedel eller någon annan produkt som plågar förekomsten av UV -strålar, antingen beläggningar eller målningar.
Å andra sidan används dibenzalaceton i organometallisk syntes av Paladium. Det fungerar som en bindning som koordinerar de metalliska paladiumatomerna, PD0, För att bilda Tris Complex (Dibenzeneacetona) Dipaladio (0).
Denna organometalliska förening ger PD -atomer0 I olika organiska synteser, så det uppför sig som en homogen katalysator, eftersom den upplöses i många organiska lösningsmedel.
På samma sätt är Dibenzalacetona som bindemedel lätt att ersätta med andra organiska bindemedel, vilket gör att den organometalliska syntesen av Paladium kan utvecklas.
Risker
När det gäller riskerna finns det inte mycket tillgänglig information som rapporterar om möjliga effekter mot hälsa eller miljön som kan leda till dibenzalaceton. I sitt rena tillstånd är det ett irriterande fast ämne för intag, andning eller direktkontakt med ögonen eller huden.
Men det är inte tydligen tillräckligt irriterande så att det inte kan vara en del av formuleringarna av solskyddsmedel. Å andra sidan,, som är så olöslig i vatten, är dess koncentration i den försumbar och presenterar sig som en solid förorening. I detta avseende är det okänt hur skadligt det är för marin fauna eller jord den grumlighet som orsakar.
Tills det motsatta har demonstrerats.
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Dibenzylidenaceton. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Dibenzylidenaceton. Pubchemdatabas., CID = 640180. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Organisk syntess. (2020). Dibenzalaceton. Hämtad från: Orsyn.org
- Dibenzalaceton av Aldol -kondensation. Hämtad från: webben.Mnstate.Edu
- « Termiska föroreningsegenskaper, konsekvenser, exempel
- Jodretri -grunder, reaktioner, allmänna procedurer, användningar »

