Elektrofilreaktioner, exempel, elektrofilicitet
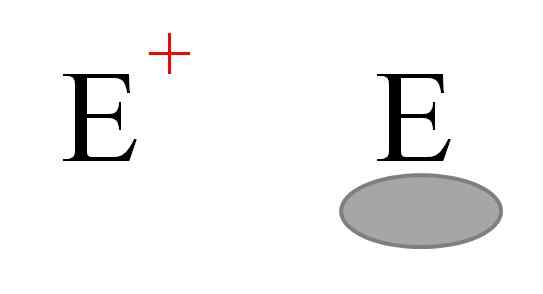
- 4910
- 1018
- PhD. Emil Svensson
En Elektrofil Det är allt kemiska arter (atom eller molekyl) som ser ivrigt ut ett par elektroner. Ordet betyder "kärlek till elektroner". Därför tenderar en elektrofi alltid att vinna eller acceptera elektroner när man deltar i kemiska reaktioner.
Vad gör en elektrofil i behov av elektroner? Du måste ha en elektronbrist, vare sig manifesteras av en partiell eller total positiv belastning, eller av en elektronisk vakansprodukt av en ofullständig valensoktett. Det vill säga vi har flera typer av elektrofiler, även om de alla accepterar par elektroner av negativa arter.
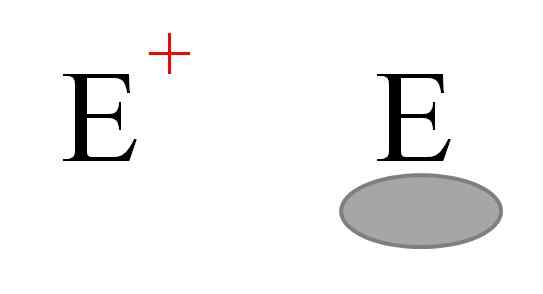 De två vanligaste typerna av elektrofiler i kemi. Källa: Gabriel Bolívar.
De två vanligaste typerna av elektrofiler i kemi. Källa: Gabriel Bolívar. Två typer av elektrofiler är i allmänhet representerade. Båda är symboliserade med brevet och. Den till vänster motsvarar en positiv belastningselektrofi, och+. Samtidigt motsvarar den till höger en elektrofil med elektronisk vakans, representerad av en gråaktig oval som indikerar frånvaron av elektroner i en orbital av Valencia.
Metallkatjoner är exempel på elektrofiler och+, liksom vissa polyiatomiska joner såsom hydronium, h3ANTINGEN+. Alhs molekyler3 och bf3, Å andra sidan är de exempel på den andra typen av elektrofiler, eftersom både aluminium och boratom har en elektronbrist eftersom de inte slutför Valenciens oktett.
[TOC]
Reaktioner
Elektrofiler reagerar och accepterar atomelektronpar med höga negativa tätheter, det vill säga elektronrika. Dessa negativa atomer eller molekyler kallas nukleofiler, Nu-, som donerar ett par elektroner till elektrofi och e e+:
Gnu- + OCH+ → Nu-e
Detta är den teoretiska grunden för många organiska reaktioner, såsom aromatisk elektrofil substitution. Nukleofilen behöver inte nödvändigtvis vara en anjon, men den kan också vara en neutral molekyl med en elektronegativ atom, såsom kväve.
Kan tjäna dig: kisel: historia, egenskaper, struktur, erhållning, användningExempel på elektrofiler
Lewis syror
Lewis -syror är elektrofiler, för per definition accepterar de elektronpar. Metalliska katjoner, mn+, Locka de negativa regionerna i de omgivande polära molekylerna i solvationsprocesserna. Således mn+ hamnar kring negativa belastningar, till och med att acceptera elektroner för att bilda koordinationskomplex.
Cucion cu2+, Till exempel är det en Lewis -syra och en elektrofil eftersom den är koordinerad med vatten syreatomer för att bilda en komplex ACU2)62+. På samma sätt som det händer med andra katjoner.
Inte alla Lewis -syror är katjoner: vissa är neutrala molekyler eller atomer. Till exempel BF3 Det är en Lewis -syra och en elektrofil för.
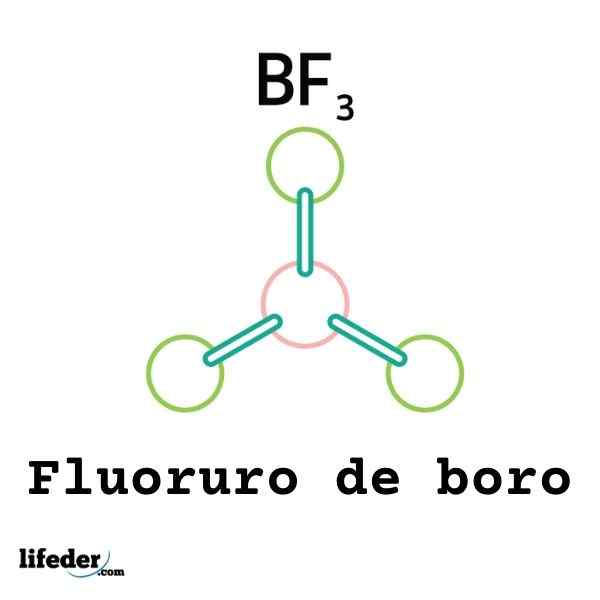
Således kommer den att kopplas till en omgivande fluoridjon för att bilda Boro Tetrafluoruro -anjonen, BF4-. Det vill säga BF3 bildar en länk med f- genom att acceptera ett par av deras elektroner.
En annan elektrofi är nitroniojon, nej2+, Vilket är en Elektrofylmedel Mycket stark bildad i nitrationsreaktionerna hos bensen. I den jonen har kväveatomen en positiv belastning, så bensenelektronerna accepterar snabbt.
Brönsted syror
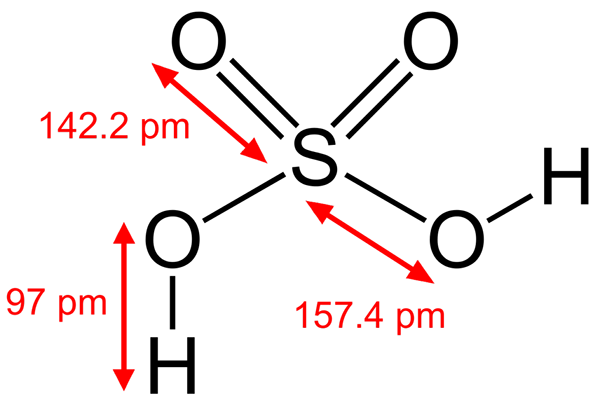 Svavelsyrastruktur
Svavelsyrastruktur Vissa brönsted syror är också elektrofiler. Till exempel hydroniumkatjonen, h3ANTINGEN+, Det är en elektrofil eftersom syreatomen har en positiv belastning. När du är väldigt elektronegativ kommer du att försöka få elektroner som donerar en av dess hydrogener för att förvandlas till en vattenmolekyl.
En annan Brönsted -syra såsom svavelsyra, h2Sw4, Det är också en elektrofil. Svavelatomen är mycket oxiderad och kommer att försöka få elektroner som donerar sina två hydrogener.
Kan tjäna dig: koltetraklorid (CCL4)Halogener
Halogener (f2, Kli2, Bras2 och jag2) De är elektrofiler. Dess atomer har inga elektroniska brister; Men deras länkar är instabila, eftersom båda atomerna, x-x, lockar mycket starkt elektroner till dem.
Därför reagerar halogener som oxiderande medel, uppför sig som elektrofiler och accepterar elektronpar för att bli halogenidanjoner (F-, Kli-, Bras- och jag-).
Halogener vinner dock inte bara elektroner på detta sätt. De kan också kopplas till mindre elektronegativa atomer än dem för att få en nettelektronförstärkning. Till exempel är detta anledningen till att de kan läggas till dubbelbindningarna för alkener eller olefiner.
Halogener representerar en annan typ av elektrofi än de två som introducerades i början. Men dess beteende i slutet är detsamma som för alla elektrofiler: Acceptera elektronpar.
Hyra och vätehalider
 CFC -molekyler är alkylhalider
CFC -molekyler är alkylhalider Hyra och vätehalider är elektrofiler där halogen kopplad atom har en stark elektronisk brist representerad av 5 -symbolen+. Detta beror på att halogenen, mycket elektronegativ, lockar till sig den elektroniska densiteten hos angränsande atom till sig själv.
För alkylhalider kommer Rx, R att ha en elektronisk brist medan X överskott av elektroner, RΔ+-XΔ-. Således, om en mycket negativ art närmar sig RX, kommer den att attackera r för att länka till den och få x att komma ut som en anjon.
Även i vätehalider, HX, har väte en elektronisk brist eller en positiv partiell belastning, hΔ+-XΔ-. Därför kommer negativa arter att ge sina elektroner till detta väte och han som elektrofil kommer att acceptera dem.
Karbonylföreningar
Syror, halogener och halider är inte de enda molekylerna som kan klassificeras som elektrofiler. Även om inte, koldioxid, co2, Det är en elektrofil, eftersom den centrala kolatomen är mycket oxiderad, eller = cΔ+= O.
Kan tjäna dig: platt bakgrundskolvDärför, när co -2 Reacta kommer att göra det att acceptera elektronpar, antingen bli karboxylat, COOH -grupp eller karbonatanjon, CO32-.
Förutom CO2, Karbonylföreningar, såsom ketoner, aldehyder och estrar är också exempel på elektrofiler, eftersom kol i dem har en positiv partiell belastning och tenderar att acceptera elektroner av mycket negativa arter.
Kargort
 Metankolatom positivt laddad
Metankolatom positivt laddad Karatorer är utomordentligt starka Lewis -syror. Det finns tertiär (r3C+), sekundär (r2Hc+) eller primär (RH2C+). Kol bildar alltid fyra bindningar, så denna katjon kommer särskilt att söka hur man accepterar elektroner på något sätt.
Elektrofilicitet
Inte alla elektrofiler är lika "hungriga" av elektroner. Vissa är mer reaktiva än andra. Ju större den elektroniska elektrofilbristen, desto större är dess känslighet för att drabbas av nukleofila attacker av negativa arter. Det vill säga det kommer att presentera större elektrofylitet, vilket är det relativa måttet på hur reaktiv är den aktuella elektrofilen.
Till exempel har carbocations, nitronium och fluorid hög elektrofylaitet; Medan koldioxid eller vissa katjoner såsom natrium har låg elektrofylitet.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Elektrofil. Hämtad från: i.Wikipedia.org
- James Ashenhurst. (2020). Nukleofiler och elektrofiler. Återhämtat från: Masterorganicchemistry.com
- Professor Patricia Shaley. (2012). Nukleofiler och elektrofiler. University of Illinois. Återhämtad från: butan.Kem.Uiuc.Edu
- Danielle Reid. (2020). Elektrofil: Definition & exempel. Studie. Återhämtat sig från: studie.com
- Tim Soderberg. (7 oktober 2019). Elektrofiler. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- « Biot-Savart lagformel, demonstration, applikationer, övningar
- Shelfords toleranslagar vad som består och exempel »

