Referenselektrodegenskaper, funktion, exempel
- 3725
- 1033
- Johan Eriksson
han referenselektrod Det är en enhet som används i potentiometrisk och voltamétrisk analys för kvantitativ bestämning av en analyt. Dess betydelse är, som namnet antyder, att tjäna som en hänvisning för att uppskatta det verkliga värdet på potentialen i reaktionen av en elektrokemisk semi -elk.
Potentialerna för en semi -media beror på koncentrationen av en jon i intresse, eftersom den reagerar genom att vinna eller förlora elektroner. På detta sätt är det möjligt att bestämma deras koncentration genom dessa potentialer. Men deras värden är inte absoluta men relaterade till standardvätelektroden (hon på engelska).
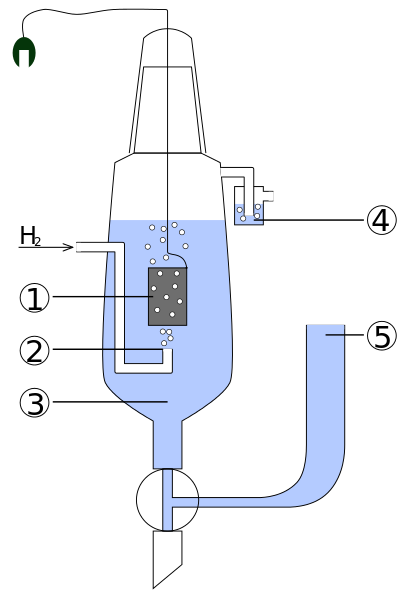
 Diagram över delar av en standard väteelektro. Källa: Standard_Hydrogen_ELectrode.JPG: Kaverinderivevative Work: Henry Muelpfordt/CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/)
Diagram över delar av en standard väteelektro. Källa: Standard_Hydrogen_ELectrode.JPG: Kaverinderivevative Work: Henry Muelpfordt/CC BY-S (http: // Creativecommons.Org/licenser/BY-SA/3.0/) Genom konvention är väteelektroder potentialer lika med 0V. Problemet är att dessa elektroder är svåra att manipulera, så de är inte praktiska att installera dem i alla analyser. Det är här referenselektroder kommer in, mycket enklare och vars potential skiljer sig från 0V.
Några av referenselektroderna, såsom Calomels mättade elektrod (ESC), kan byggas i samma laboratorium innan analysen utförs. På samma sätt erhålls de öppet på marknaden med sina korrekta specifikationer, och riskerna för att förorena provet på analyt är minimala.
[TOC]
Referenselektrodegenskaper
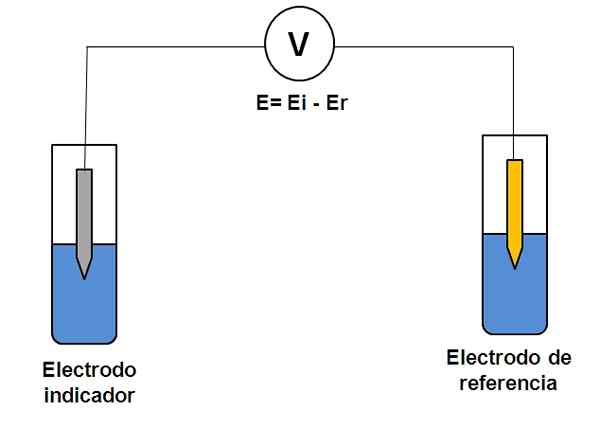 Enkel representation av ett två elektrodsystem i potentiometri. Källa: Gabriel Bolívar.
Enkel representation av ett två elektrodsystem i potentiometri. Källa: Gabriel Bolívar. Tänk på de två elektrodersystemet ovan. Den ena är indikatorn (grå), där reaktionen av intresse äger rum, och den andra är referensen (guld). Denna elektrokemicell kommer att ha en potential och, som kommer att vara lika med skillnaden mellan potentialen för båda elektroderna (EI-E). Därför måste varje variation i E bero på indikatorelektrodens potential.
Kan tjäna dig: kaliumcyanid (KCN): egenskaper, användningar, strukturer, risker,Från ovanstående dras det att referenselektroden har följande egenskaper:
-Den har en stabil potential under tiden och är reproducerbar. Det vill säga det bör vara detsamma oavsett var eller hur många gånger mätningarna görs.
-Dess kemiska sammansättning är konstant och okänslig, så den genomgår knappast förändringar när den interagerar med lösningen av analyt eller fördjupar sig i ett vattenhaltigt medium.
-Det är lätt att bygga och montera, till skillnad från standardvätelektroden, som kräver användning av en vätentank och kör explosionsrisker när väte blandas med luften med luften.
Indikatorelektroden är en som är känslig för analytkoncentrationen.
Referenselektrodfunktion
Referenselektroder Potentialer mäts mot standardvätelektroden, så deras värden skiljer sig från 0V. Tack vare dessa väteelektroder är konstruktionen av standard- och º -standardpotentialtabeller möjlig, som visas i kemi -texterna för redoxreaktioner symfiner.
Men i praktiken laddar det inte en vätelektrod överallt. Istället används referenselektroder, mycket enklare och säkert för att manipulera.
Eftersom dess potentialer är konstant och stabila beror de potentiella avläsningarna av elektrokemi -cellen uteslutande på indikatorelektroden; det vill säga till variationerna i koncentrationen av analyten i fråga.
Således är referenselektrodfunktionen att bestämma potentialen för någon reaktion i en av semi -begränsningarna i det elektrokemiska systemet. Om deras potential inte var stabila, skulle de kvantitativa bestämningarna av analyt inte vara tillförlitliga. Alla potentiometrisk eller voltametrisk analys bör ange vilken referenselektrod de använde för att rapportera sina resultat.
Det kan tjäna dig: bromsyra (Hbro2): fysiska och kemiska egenskaper och användningarReferenselektroder Exempel
Det finns flera tillgängliga referenselektroder på marknaden. Vissa använde för mycket specifika bestämningar. Det finns emellertid två elektroder bland dem alla som sticker ut tack vare deras enkelhet och praktiska: Calomel-elektroden och silver silver-klorid, båda mycket återkommande i många potentiometriska och voltamletriska analyser.
Kalomelelektrod
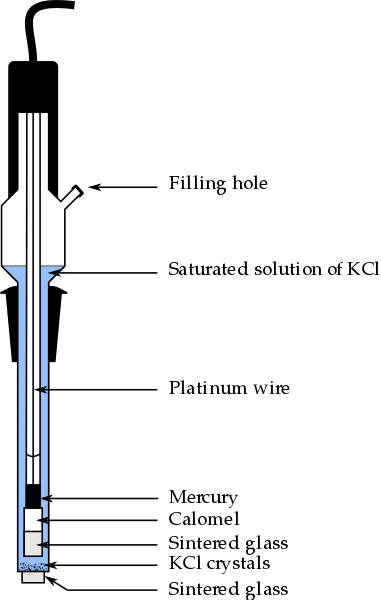 Delar av Calomel -elektroden, en av de mest använda referenselektroderna i analytisk kemi. Källa: Bachi-Bouzouk via Wikipedia.
Delar av Calomel -elektroden, en av de mest använda referenselektroderna i analytisk kemi. Källa: Bachi-Bouzouk via Wikipedia. I den övre bilden visas de konventionella delarna av en mättad kalomelelektrod, ECS. Det sägs att det är mättat eftersom det innehåller en mättad lösning av KCl (blå), som också presenterar uns av KCL.
Den inre kolumnen, rest med en platina tråd, är fylld med kvicksilver, som i sin tur kontakter en kalomelpasta, Hg2Kli2 O kvicksilverklorid (I) och den mättade lösningen av KCl. I denna elektrod är således koncentrationen av Cl -jonerna viktig-, Eftersom dess värde modifierar elektrodens potential.
Reaktionen som äger rum är som följer:
Hg2Kli2(s) + 2e- ⇌ 2Hg (L) + 2Cl-
Och den har en eº på 0.241 v.
I den nedre änden av ECS finns en porös stekt, som läggs i elektrisk kontakt med lösningen av analyt och tillåter det kontrollerade utbytet av jonjoner-. Annars skulle det vara förorening av klorider i provet, och även elektroden skulle förlora sin dyrbara mättade KCL -lösning.
Denna elektrod används för pH -mätningar och i allmänhet av alla analyt vars koncentration kan bestämmas i ett vattenhaltigt medium.
Det kan tjäna dig: termisk alkohol: struktur, egenskaper, risker och användningarSilver Silverelektrod
 Silver Silver Electro. Källa: TenofAllTrades (Talk) (uppladdningar). / Allmängods
Silver Silver Electro. Källa: TenofAllTrades (Talk) (uppladdningar). / Allmängods I likhet med Calomels elektrod består silver silverelektroden av en silvertråd täckt med silverklorid, och också nedsänkt i en lösning mättad av en blandning av KCl och AgCl.
Alla dess delar är skyddade i ett plaströr, som har en porös öppning genom vilken den skapar elektrisk kontakt med lösningen.
Reaktionen som definierar dess potential, eº = 0.197 V, är som följer:
Agcl (s) + e- ⇌ Ag (s)+cl-
Denna elektrod presenterar större användningsområden och preferenser än Calomel, vilket beror på den negativa påverkan av kvicksilver på miljön. Å andra sidan är silverfasta silverelektroder enklare, säkra och billiga att bygga in laboratoriet.
Vi säger då att silver-gaffelektroden ersätter Calomel i många av dess tillämpningar (potentiometriska grader, korrosionstester, elektrokemisk analys etc.).
Det är också ett av de föredragna alternativen inom biologi och medicin, särskilt för elektrokardiografi och elektroencefalografi, eftersom silver eller deras salt är relativt toxiska ämnen för kroppen.
Referenser
- Dag, r., & Underwood, a. (1965). Kvantitativ analytisk kemi. (Femte ed.). Pearson Prentice Hall.
- Skoog d.TILL., West D.M. (1986). Instrumentalanalys. (Second ED.). Mellanamerikansk., Mexiko.
- Wikipedia. (2020). Elektrodreferens. Hämtad från: i.Wikipedia.org
- Elsevier b.V. (2020). Elektrodreferens. Vetenskaplig. Hämtad från: Scientedirect.com
- Kemi librettexts. (9 juni 2020). Referenselektroder. Återhämtad från: kem.Librettexts.org
- « Alexandria fyrplats, historia, beskrivning, ruiner
- Emily Dickinson Biografi, prestationer, verk, fraser »

