Inre energi

- 3109
- 376
- Per Eriksson
Vi förklarar vilken intern energi är, dess funktion, hur man beräknar den och ger flera exempel
 Diagram som visar bidrag till den inre energin i ett system. Källa: f. Zapata
Diagram som visar bidrag till den inre energin i ett system. Källa: f. Zapata Vad är intern energi?
De inre energi Från ett objekt kommer från den slumpmässiga rörelsen som atomerna och molekylerna som komponerar den har. Även när objektet är perfekt i vila, inuti, på mikroskopisk nivå, rör sig partiklarna som komponerar det kontinuerligt utan vila.
Eftersom dessa partiklar rör sig har de kinetisk energi, som är en del av deras inre energi. Det andra bidraget till intern energi är den potentiella energin som kommer från intermolekylära krafter, ansvariga för att upprätthålla sammanhållningen av ämnet.
Dessa intermolekylära krafter är vanligtvis av elektromagnetiskt ursprung, men gravitations- och kärnkrafter deltar också.
Beroende på typen av rörelse av partiklar kan kinetisk energi vara:
- Översättnings-
- Vibration
- Rot-
Temperaturen mäter endast partiklarnas translationella kinetiska energi. I princip, vid större temperatur, kommer den inre energin att bli större, men detta beror också på massan. En exempel Frågan klargörs: Ett glas med varmt vatten har mindre inre energi än en sjö vid rumstemperatur, även om temperaturen på glaset är högre, och det beror på att det finns mer vatten i sjön än i glaset.
I alla fall märks inte den inre energin i ett ämne i synen, den beror inte på dess rörelse, och den beror inte heller på dess relativa position med avseende på andra föremål. Till exempel är den inre energin i ett glas med vatten vid rumstemperatur densamma om glaset är på ett bord eller om det är på golvet.
Kan tjäna dig: icke -koplanära vektorer: definition, förhållanden, övningarIntern energifunktion
Intern energi, som vanligtvis betecknas som u, är en funktion som beror på de termodynamiska variablerna i systemet, såsom temperatur t och volym v. Därför kan det uttryckas matematiskt som:
U = u (t, v)
I verkligheten är det absoluta värdet på den inre energin i ett system inte relevant, det som är viktigt är dess variation, som betecknas med den grekiska bokstaven Δ (“Delta”):
Δu = u första - ELLER slutlig
Nu kan intern energi varieras om värme tillsätts eller extraheras. Att lägga till värme är det möjligt att systemet gör ett visst jobb, till exempel en kolv i en motorcylinder.
Termodynamikens första lag
Från den första lagen om termodynamik är det fastställt att Variationen av intern energi Från ett system som motsvarar:
Δu = q - w
Där vad är mängden värme som överförs till systemet och w är det arbete som systemet gör, om det utför några. Allt mäts i joules i det internationella enhetssystemet.
Om systemet inte fungerar används värmen som levereras i sin helhet för att öka systemets inre energi.
Följande följer av det tidigare uttrycket:
- ΔU> 0 betyder att systemet ökar sin inre energi
- Δu < 0 la energía interna del sistema disminuye
- Q> 0 Systemet absorberar värme
- W> 0 systemet fungerar.
Hur man beräknar intern energi?
Den monoatomiska idealiska gasen
I den monoatomiska ideala gasmodellen (en enda atom) interagerar inte partiklar med varandra, så att translationell kinetisk energi är det enda bidraget till intern energi eller gas. Det finns ett teorem som kallas Utrustningssats, som säger att varje frihetsgrad har en energi som är lika med:
Det kan tjäna dig: vågdiffraktion: koncept och exempelDär t är temperaturen och r är konstanten för de ideala gaserna, vars värde i enheter i det internationella systemet är:
8.314472 j/mol ∙ k
En frihetsgrad representerar möjligheten att röra sig under en viss riktning i rymden. En idealisk gaspartikel kan röra sig i rymdets tre riktningar, därför är energin från n mullvad med gas:
Värmebelopp
Förutsatt att värme läggs till i ett system och detta fungerar inte, denna värme används endast för att öka systemets inre energi. Mängden värme som måste vara proportionell mot systemets massa M och temperaturförändringen:
Q ∝ m⋅Δt
Proportionalitetskonstanten beror på ämnet och kallas specifik värme. Calling C till denna konstant är värmen:
Q = mc⋅Δt
När värmen vänds för att öka den inre energin:
Q = mc⋅Δt = ΔU
ΔU motsvarar variationen I inre energi.
Exempel på intern energi
1. Temperaturvariationer
Förändringar i temperaturen på ämnena genererar i sin tur förändringar i deras inre energi. Det här är vad som händer, till exempel när du lagar mat. Genom att värma mat ökar agitationen av dess molekyler, kinetisk energi ökar och gör därför sin inre energi.
2. Inre energi hos två ämnen vid samma temperatur
Två ämnen vid samma temperatur har inte nödvändigtvis samma inre energi, eftersom det beror på två bidrag: kinetisk energi och potentiell energi.
Om ämnena är vid samma temperatur kan det bekräftas att den translationella kinetiska energin hos dess partiklar är densamma, men den potentiella energin är annorlunda, eftersom detta beror på konfigurationen av beståndsatomerna.
Kan tjäna dig: hydrostatisk tryck: formel, beräkning, exempel, övningar3. Termisk expansion
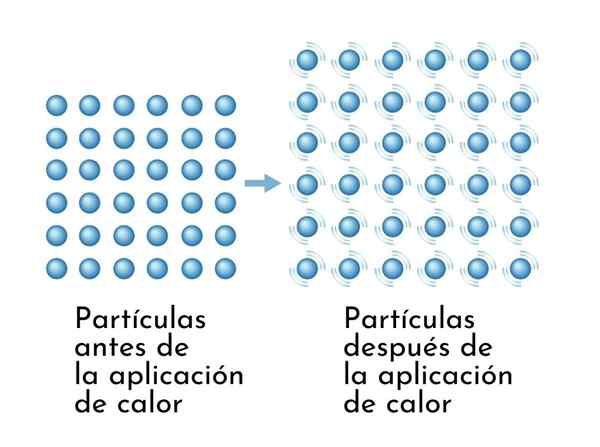 Ämnen expanderar när de upphettas, eftersom ökningen av inre energi får deras partiklar att vibrera mer, så dimensionerna ökar
Ämnen expanderar när de upphettas, eftersom ökningen av inre energi får deras partiklar att vibrera mer, så dimensionerna ökar En synlig konsekvens av uppvärmningsämnen är ökningen i deras dimensioner, eftersom det genomsnittliga avståndet mellan dess atomer ökar.
Intermolekylära krafter kan simuleras genom fjädrar som förenar atom.
4. Komprimerade gaser
Komprimerade gaser kan lagra inre energi, eftersom deras densitet ökar genom att minska volymen och med den är dess interaktioner med väggarna i behållaren behållare. På detta sätt kan en komprimerad gas göra ett jobb som att flytta en kolv.
5. Batterier
I ett batteri förekommer kemiska reaktioner som kan generera en elektrisk ström så snart kretsen stängs. Denna kemiska potentiella energi betraktas som en del av systemets inre energi.
6. System som absorberar värme och fungerar
När ett system absorberar värme ökar det sin inre energi. Men om han samtidigt gör ett jobb kan den första termodynamikens lag användas för att veta hur mycket intern energi förändras. Till exempel, förutsatt att ett system absorberar 175 J värme och utför ett jobb motsvarande 62 J, är förändringen i dess inre energi:
ΔU = Q - W = 175 J - 62 J = 113 J.



