Dubbel kovalent bindning

- 874
- 135
- Per Karlsson
Vi förklarar vad en dubbel kovalent bindning är, dess egenskaper och ger flera exempel
 Eteno- eller etylenmolekyl. Det är ett typiskt exempel på en dubbel kovalent bindning mellan två kolatomer
Eteno- eller etylenmolekyl. Det är ett typiskt exempel på en dubbel kovalent bindning mellan två kolatomer Vad är en dubbel kovalent bindning?
De dubbla kovalenta bindningar De är kemiska länkar där två atomer delar två par elektroner. Med andra ord är de kovalenta bindningar bildade av totalt fyra valenselektroner som kretsar kring två atomer.
Dubbel länkar är mycket vanliga i organiska föreningar. Till exempel har alla alkener en dubbel kol-kol-bindning. Många andra funktionella grupper som aldehyder, ketoner, karboxylsyror och amider har också dubbla kovalenta bindningar mellan kol och syre. Andra, såsom imin har dubbla kovalenta bindningar c = n.
Dubbellänkar har många egenskaper som skiljer dem från andra typer av kovalenta bindningar som enkla länkar och trippellänkar. De skiljer sig åt i form av molekylerna som innehåller dem, i längden och länkkraften och andra egenskaper relaterade till deras kemiska egenskaper.
Dubbel kovalenta länkegenskaper
De bildas av fyra elektroner
Anledningen till att dubbelbindningar beror på att de innehåller dubbla elektroner av en enkel kovalent bindning, som bildas när två atomer delar två valenselektroner. Detta innebär att varje dubbelbindning innehåller 4 elektroner.
De bildas av en sigma -länk (σ) och en Pi (π) länk
Av de fyra elektronerna som bildar en dubbelbindning går 2 av dem och kommer mellan en atom och en annan, som passerar genom mitten av de två. Detta par elektroner kallas sigmaelektroner, eftersom de bildar en Sigma -bindning (σ).
Det andra elektronparet flyter över och under de två atomerna som gör en slags smörgås. Dessa elektroner kallas Pi -elektroner och bildar en pi (π) länk.
Kan tjäna dig: klorbensen (C6H5Cl)Tillsammans bildar sigma -länken och PI -länken den dubbla kovalenta bindningen.
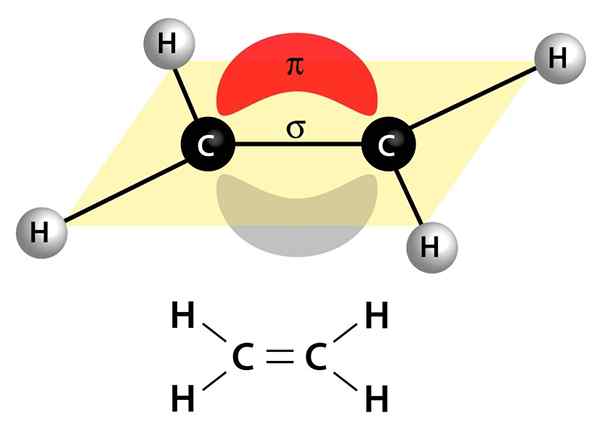 Den här bilden visar de två länkarna som utgör en dubbelbindning: PI -länken som visas som ett rött och grått moln som är över och under molekylen, och sigma -länken som är linjen som ansluter sig till båda kärnorna genom mitten
Den här bilden visar de två länkarna som utgör en dubbelbindning: PI -länken som visas som ett rött och grått moln som är över och under molekylen, och sigma -länken som är linjen som ansluter sig till båda kärnorna genom mitten De kan vara polära eller apolära
Beroende på elektronegativiteten hos atomerna som är förenade med hjälp av en dubbel kovalent bindning kan den vara polär eller apolär.
Till exempel en dubbel kovalent bindning C = c Det kommer att vara en apolär länk, eftersom båda atomerna är desamma och har samma elektronegativitet. Istället en dubbel kovalent bindning C = O Det kommer att vara polärt, eftersom syre är mycket mer elektronegativt än kol.
De är starkare än enkla länkar
Att bryta en dubbelbindning är svårare än att bryta en enkel koppling mellan samma två atomer. Detta beror på att, för att bryta en dubbelbindning, både en sigma -länk (som är lika med den enkla länken) och en PI -länk måste brytas. Eftersom två länkar måste brytas istället för en är dubbelbindningen starkare än den enkla.
De är svagare än trippellänkar
Jämfört med trippellänken är dubbelbindningen svagare och lättare att bryta. Anledningen är densamma som tidigare, bara att i det här fallet har dubbelbindningen mindre länkar än att bryta jämfört med trippellänken.
De är kortare än enkla länkar
Som starkare länkar än enkla länkar kan dubbelbindningar föra länkade atomer närmare än enkla länkar än enkla länkar. Av denna anledning, om en dubbel C = C-länk jämförs med en enkel C-C-länk, är den första alltid kortare än den andra.
Kan tjäna dig: natriumtiosulfat (Na2S2O3)De är längre än trippellänkar
Återigen, när trippellänken är starkare än dubbellänken, är trippellänken kortare. Detta innebär att dubbla kovalenta bindningar är längre än trippel.
De är styva länkar.
Enkla kovalenta bindningar är ganska flexibla och kan också rotera. Å andra sidan är dubbelbindningarna styva, de är inte flexibla och kan inte roteras, eftersom PI -länken som nämnts ovan skulle brytas.
De representerar omättnad
En molekyl som har en dubbelbindning kommer att ha två mindre kopplade väteatomer än det kunde ha. Av denna anledning sägs det att en dubbelbindning representerar en omättning (varje omättning motsvarar 2 hydrogener).
De bildar platt triangelformade molekyler
En kolatom som bildar en dubbel kovalent bindning och två andra enkla bindningar, bildar alltid en platt molekyl där de tre bindningarna pekar på ändarna på en triangel. Denna form kallas platt trigonal geometri.
Exempel på dubbla kovalenta bindningar
Länk C = C i eten
Etylen är ett av de enklaste exemplen på en dubbel kovalent bindning, i detta fall mellan två kolatomer.
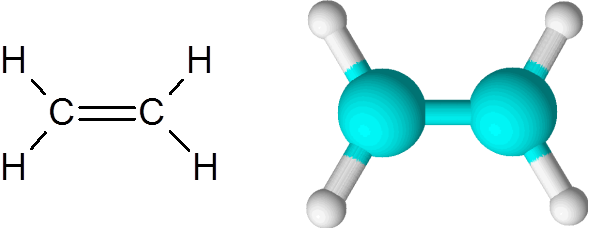 Etylenmolekyl
Etylenmolekyl Molekylen är helt platt och det är inte möjligt att rotera länken i någon riktning. Denna dubbelbindning är helt apolär, eftersom den länkar två lika atomer.
Länk C = O i aceton
Alla ketoner innehåller en karbonylgrupp, som består av en kolatom och en syreatomförenad med en dubbel kovalent bindning.
Kan tjäna dig: vad är kemisk kinetik?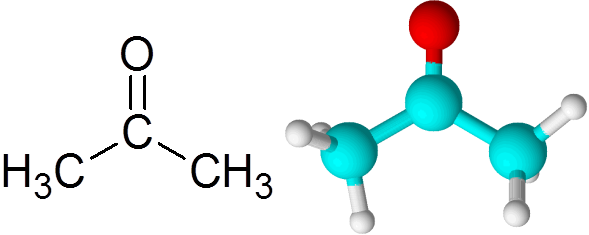 Acetonmolekyl
Acetonmolekyl Varje atom bidrar med två saknade elektroner för att bilda både PI- och Sigma -länken som utgör dubbelbindningen. De flesta av de kemiska reaktionerna som uppstår till ketoner beror på dubbelbindningen C = O.
Länken o = eller i ozonmolekylen (eller3)
I detta fall är den centrala syreatomen kopplad till två andra syreatomer. En av de två bindningarna bildas av 4 elektroner, så den motsvarar en dubbel kovalent bindning. De tre atomerna och ett par elektroner utan att dela som har den centrala syreatomen är alla i samma plan på skärmen som pekar på hörnen på en triangel.
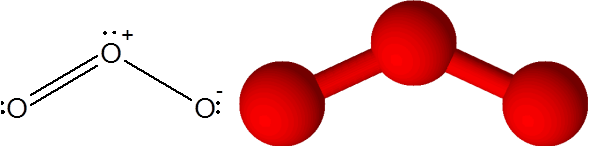 Ozonmolekyl
Ozonmolekyl Ozon har det speciella att dubbelbindningen kan "hoppa" från ett av terminalens syre till det andra. I själva verket gör han det mycket snabbt genom en process som heter resonans.
C = c -länkar i butadieno (c4H6)
Butadieno är ett exempel på en organisk förening som har två dubbla kovalenta bindningar c = c.
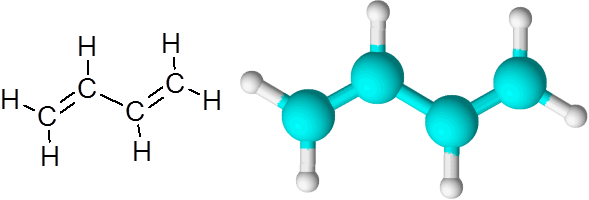 1,3-butadienmolekyl
1,3-butadienmolekyl När dubbelbindningarna är på detta sätt, åtskilda med en enda enkel länk, sägs det att de är konjugerade dubbla länkar.

