Entalpía
- 2367
- 614
- Johan Johansson
Vad är entalpi?
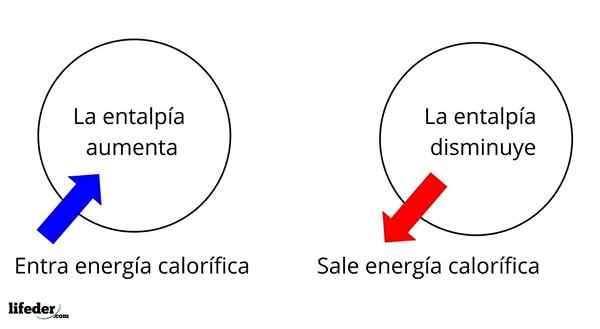
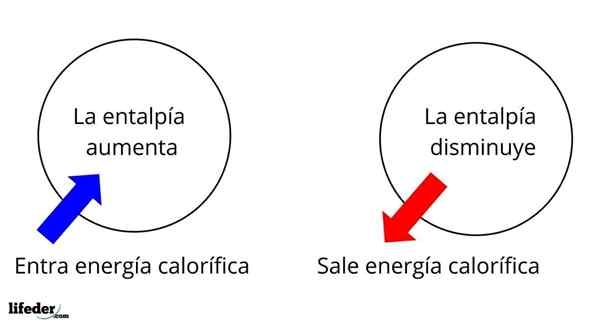
De entalpía Det är en termodynamisk egenskap vars variation, under konstant temperatur och tryckförhållanden, bestämmer den kaloriska energin hos ett ämne eller ett system associerat med en kemisk reaktion eller fysisk process. Som en tillståndsfunktion representeras den med bokstaven i kapital H, som är ΔH dess variation.
Det är en av de mest grundläggande omfattande egenskaperna att studera termokemin för många reaktioner; Det vill säga vi pratar om frigöring eller absorption av värme mellan reaktionsmediet och dess omgivningar. Således säger vi att en reaktion är exoterm om dess ΔH är negativ (ΔH 0).
 Förändringen av entalpi i isen är positiv, vilket indikerar att isen absorberar värme från miljön för att flytta till flytande tillstånd, vattnet
Förändringen av entalpi i isen är positiv, vilket indikerar att isen absorberar värme från miljön för att flytta till flytande tillstånd, vattnet Is har till exempel en entalpi, his, Medan vatten också har sin egen entalpi, hvatten. När isen smälter inträffar en entalpivariation, kallad ΔHFus eller smältande värme (hvatten-His). Vatten entalpi är överlägsen is, vilket orsakar ΔhFus För isen är positiv och har ett +6 -värde.01 kJ/mol.
Entalpi och dess variation uttrycks vanligtvis i Joule- eller kalorienheter. Förändringen av entalpi +6.01 kJ/mol indikerar att en ismol måste absorbera 6.01 kJ kalorenergi eller värme för att smälta.
Hur beräknas entalpia?
Entalpi och dess variation
Entalpi i sig är oöverskådlig, eftersom det beror på variabler som är svåra att mäta exakt. En bra jämförelse skulle vara att vilja mäta havens totala volym: det kommer alltid att finnas delar av det under jorden eller spridda bland kontinenterna. Därför kan H kan inte fastställas; Men ja ΔH.
Kan tjäna dig: kolloidFör att nå ett matematiskt uttryck som möjliggör beräkning av ΔH, måste det först vara kvar av den grundläggande definitionen av entalpi:
H = u + pv
Att vara den inre energin i systemet eller ämnet i fråga, och pv tryckvolymarbete som detta system utövar på omgivningen att existera. Eftersom vi är intresserade av att beräkna Δh och ingen h, har vi:
ΔH = ΔU + Δ (PV)
Om trycket är konstant kommer ekvationen att kvarstå:
ΔH = ΔU + PΔV
Vi vet å andra sidan att:
ΔU = q + W
Varelse q Värme och W -arbete. Ersätter oss:
ΔH = q + W + PΔV
Men dessutom vet vi det:
W = - pδv
Och därför:
ΔH = q - PΔV + PΔV
ΔH = q
Det vill säga ΔH för en reaktion eller process, som utförs under konstant tryck, kommer att vara lika med värme q genererad eller absorberad.
Reaktioner entalpi förändras
Antagandet att trycket förblir konstant är möjligt om reaktionen inträffar under jordens atmosfär. Till exempel smälter isen i vinterlandskap utan att uppleva ett annat tryck än vår atmosfär. Å andra sidan gäller det också reaktioner i flytande media, eller de som inte producerar stora mängder gaser.
Dessa reaktioner absorberar eller släpper värme q Lika med ΔH, vilket i sin tur är skillnaden i entalpier mellan produkter och reaktanter:
ΔH = hProdukter - HReaktanter
Typer av entalpi
Det är en vanlig praxis att prata om Δh och h som om de var desamma: båda kallas entalpier. Men när det gäller typerna är H dock unikt för varje ämne eller system; Medan Δh, å andra sidan, är föremål för reaktionens eller processens natur i sig själva.
I denna mening har vi först positiva entalpivariationer (ΔH> 0) eller negativa (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Det kan tjäna dig: nitrobensen (C6H5N2): Struktur, egenskaper, användningar, riskerTecknet '+' eller '-' som följer med ΔH berättar därför om det finns befrielse eller absorption av värme i en viss reaktion eller process; som har sina ΔH -egenskaper, som en del av deras termokemiska egenskaper.
Vi har oändligheter av typer av entalpier, som kan klassificeras enligt fysiska processer eller kemiska reaktioner.
Fysiska processer
Fasbyte entalpi
Ämnen måste absorbera eller frigöra värme för att röra sig från en material- eller materialfas (fast, vätska eller gas) till en annan. Till exempel absorberar is värme för att smälta, så entalpi för denna fasförändring motsvarar fusion, ΔHFus, kallas också latent värmevärme.
Entalpi av upplösning eller blandning
Ämnen när de är upplösta eller blandade i ett lösningsmedelmedium kan absorbera eller frigöra värme, vilket har en entalpi ΔHDis eller ΔHBlanda.
Kemiska reaktioner
Träningsparthy
Det är den tillhörande värmen, ΔHºF, till bildandet av en förening, särskilt en mol, från dess beståndsdelar i standardförhållanden för tryck och temperatur (t = 298.15 K och P = 1 atm).
Sönderdelningsentalpi
Det är den tillhörande värmen, Δhdes, till nedbrytningen av en förening i mindre och enkla ämnen. Det är i allmänhet positivt, eftersom värme behövs för att bryta molekylernas bindningar.
Hydreringsenthalpi
Det är den tillhörande värmen, Δhh, Till beroende av en vätemolekyl till en förening, vanligtvis ett kolväte.
Förbränningsentalpi
Det är värmen som släpps, Δhhårkam, När ett ämne brinner med syre. Det är negativt, eftersom värme och ljus släpps (eld).
Det kan tjäna dig: atommassa: definition, typer, hur man beräknar den, exempelExempel på entalpier
Slutligen kommer omnämnandet av några specifika exempel på entalpier att göras:
Metanförbränning
Ch4 + 22 → CO2 + 2h2ANTINGEN
ΔH = -890.3 kJ/mol
Det vill säga en mol av Cho4 När förbränning befriar 890.3 kJ kalorivergi.
Väte av eten
Ch2= Ch2 + H2 → Ch3Ch3
ΔH = -136 kJ/mol
En mullvad eten släpper ut 136 kJ värme när väte för att bli en etan.
Salt i vatten
Tabellsalt, NaCl, upplöses i vattnet för att separera Na -jonerna+ och cl- av kristallina nätverk och omgivning (hydrat) av vattenmolekyler:
NaCl (S) → NA+(Ac) + cl-(Ac)
ΔH = +3.87 kJ/mol
Det vill säga upplösning av salt i vatten, i enlighet med att kyla glaset eller behållaren. Den absorberade mängden värme är emellertid mycket liten, så våra händer kommer bara att känna en liten temperaturförändring.
Kaliumkloratupplösning i vatten
Å andra sidan, kaliumkloratet, KCLO3, Den har en ΔhDis mycket positivt:
KCl3(S) → K+(AC) + CLO3-(Ac)
ΔH = +41.38 kJ/mol
Vilket innebär att för att lösa upp i vattnet absorberar det mycket varmt. Och därför kommer behållaren att svalna avsevärt, och vi kommer att se att den omgivande vattenånga kommer att fukta sin yttre yta.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Wikipedia. (2020). Entalpi. Hämtad från: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (28 augusti 2020). Entalpin definition inom kemi och fysik. Återhämtat sig från: tankco.com
- Andrew Rader Studios. (2015). Energi och entalpi. Återhämtat sig från: physics4kids.com
- Kiddle. (2020). Entalpi fakta för barn. Hämtad från: fakta.Kiddle.co
- Administration. (21 december 2010). Entalpin. Återhämtat sig från: oxyorganisk kemikalie.com
- María Estela Raffino. (11 juli 2020). Entalpia -koncept. Återhämtat sig från: koncept.av

