Termiska jämviktsekvationer, applikationer, övningar

- 3131
- 242
- Anders Larsson
Den termiska balansen mellan två kroppar som är i termisk kontakt är det tillstånd som uppnås efter en tillräckligt lång tid så att båda kroppens temperaturer är lika med.
I termodynamik förstås termisk kontakt med två kroppar (eller två termodynamiska system) som en situation där kropparna har mekanisk kontakt eller är separerade men i kontakt med en yta som endast tillåter värmepassage från en kropp till den andra (diatermisk yta ).
-
 Figur 1. Efter ett tag kommer isen och drycken att nå sin termiska balans. Källa: Pixabay
Figur 1. Efter ett tag kommer isen och drycken att nå sin termiska balans. Källa: Pixabay
Vid termisk kontakt bör det inte finnas någon kemisk reaktion mellan systemen i kontakt. Det bör bara vara värmeväxling.
Vardagliga situationer där det finns värmeutbyte presenteras med system som kall dryck och glas, varmt kaffe och tesked eller kropp och termometern, bland många andra exempel.
[TOC]
När två eller flera system är i termisk jämvikt?
Den andra lagen om termodynamik konstaterar att värme alltid går från den högsta temperaturkroppen till den lägsta temperaturen. Värmeöverföring upphör så snart temperaturen utjämnas och den termiska jämviktsstatusen uppnås.
Den praktiska appliceringen av termisk jämvikt är termometern. En termometer är en anordning som mäter sin egen temperatur, men tack vare värmebalansen kan vi veta temperaturen på andra kroppar, till exempel en person eller ett djur.
Kvicksilverkolonnens termometer placeras i termisk kontakt med kroppen, till exempel under tungan, och tillräckligt med tid förväntas nå den termiska balansen mellan kroppen och termometern och att dess läsning inte varierar mer mer.
När denna punkt uppnås är termometertemperaturen densamma som kroppen.
Nolllagen för termodynamik konstaterar att om en kropp A är i termisk jämvikt med en kropp C och samma kropp C är i termisk jämvikt med B, är A och B i termisk jämvikt även när mellan A och B inte finns någon termisk kontakt.
Vi drar slutsatsen att två eller flera system är i termisk jämvikt när de har samma temperatur.
Termisk jämviktsekvationer
Vi antar en kropp vid initial temperatur i termisk kontakt med en annan B -kropp med initial TB -TB. Vi antar också att ta> tb, sedan enligt den andra lagen överförs värmen från a till b.
Efter ett tag kommer den termiska balansen att nås och båda kropparna kommer att ha samma slutliga temperatur TF. Detta kommer att ha ett mellanvärde till TA och TB, det vill säga ta> tf> tb.
Mängden värme som överförs från a till b kommer att vara qa = ma ca (tf - ta), där ma är massan av kropp a, ca värmekapaciteten per enhetsmassa för en y (tf - ta) temperaturskillnaden. Om TF är mindre än då är QA negativt, vilket indikerar att kroppen ger värme.
På liknande sätt för kropp B måste du till QB = MB CB (TF - TB); Och om TF är större än TB är QB positivt, vilket indikerar att kropp B får värme. Eftersom kropp A och B är i termisk kontakt mellan dem, men isolerade från miljön, bör den totala mängden utbyte värme vara noll: QA + QB = 0
Sedan ma ca (tf - ta) + mb cb (tf - tb) = 0
Balanstemperatur
Utveckla detta uttryck och rensa TF -temperaturen erhålls den slutliga termiska jämviktstemperaturen.
-
 figur 2. Slutlig balanstemperatur. Källa: Självgjord
figur 2. Slutlig balanstemperatur. Källa: Självgjord
TF = (MA CA TA + MB CB TB) / (MA CA + MB CB).
Som ett särskilt fall, tänk på att kroppen A och B är identiska i massa och i värmekapacitet, i detta fall kommer jämviktstemperaturen att vara:
Tf = (ta + tb) / 2 ↔ om ma = mb och ca = cb.
Termisk kontakt med fasförändring
I vissa situationer händer det att när två kroppar placeras i termisk kontakt orsakar värmebörsen förändringen av tillstånd eller fas i en av dem. Om detta händer måste det beaktas att under fasförändringen finns det ingen temperaturförändring i kroppen som modifierar dess status.
Om fasförändringen av en av kropparna i termisk kontakt inträffar, appliceras begreppet latent värme L, vilket är energin per massa enhet som är nödvändig för att ändra statens förändring:
Q = l ∙ m
För att smälta 1 kg is vid 0 ° C krävs till exempel 333,5 kJ/kg och det värdet är den latenta ismältningen.
Under fusionen ändras fast vatten till flytande vatten, men att vatten upprätthåller samma istemperatur under fusionsprocessen.
Ansökningar
Termisk balans är en del av det dagliga livet. Låt oss till exempel undersöka denna situation i detalj:
-Övning 1
En person vill bada med varmt vatten vid 25 ° C. På en kubplats 3 liter kallt vatten vid 15 ° C och i köket värme vatten upp till 95 ° C.
Hur många liter varmt vatten måste lägga till i kallt vattenkub för att ha önskad sluttemperatur?
Lösning
Anta att det är kallt vatten och B varmt vatten:
-
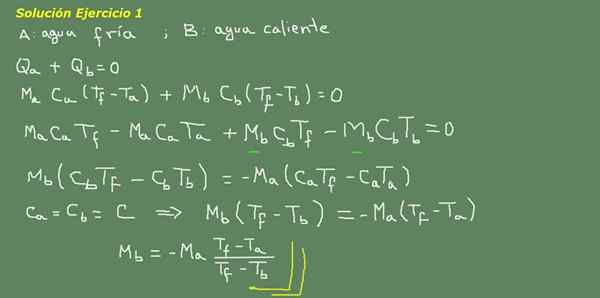 Figur 3. Övning 3 Lösning. Källa: Självgjord.
Figur 3. Övning 3 Lösning. Källa: Självgjord.
Vi föreslår den termiska jämviktsekvationen, som anges på kortet i figur 3 och därifrån rensar vi MB -vattnet.
Den initiala massan av kallt vatten kan erhållas eftersom tätheten på vattnet är känd, vilket är 1 kg för varje liter. Det vill säga vi har 3 kg kallt vatten.
Ma = 3 kg
Så
MB = - 3 kg*(25 ° C - 15 ° C)/(25 ° C - 95 ° C) = 0,43 kg
Då räcker det med 0,43 LTS varmt vatten för att äntligen få 3,43 liter varmt vatten vid 25 ° C.
Löst övningar
-Övning 2
En bit metall på 150 g massa införs och med 95 ° C -temperatur till en behållare som innehåller en halv liter vatten vid en temperatur av 18 ° C. Efter ett tag nås den termiska balansen och temperaturen på vatten och metall 25 ° C.
Anta att behållaren med vatten och metallstycke är en stängd termos som inte tillåter värmeväxling med miljön.
Få den specifika metallvärmen.
Lösning
Först kommer vi att beräkna värmen som absorberas av vatten:
Qa = ma ca (tf - ta)
QA = 500G 1CAL/(G ° C) (25 ° C - 18 ° C) = 3500 kalorier.
Det är samma värme som ges av metall:
QM = 150 g cm (25 ° C - 95 ° C) = -3500 kalorier.
Då kan vi få metallens värmekapacitet:
Cm = 3500 kal/ (150g 70 ° C) = ⅓ Cal/ (g ° C).
Övning 3
Du har 250 c.c. vatten vid 30 ° C. Till det vattnet som är i en isolerande termos läggs 25 g isbitar vid 0 ° C, med syftet att kyla det.
Bestämma jämviktstemperaturen; Det vill säga temperaturen som kommer att förbli när all isen har smälts och isvattnet har upphettats tills vattnet som ursprungligen hade glaset.
Lösning 3
Denna övning kan lösas i tre steg:
- Den första är fusionen av is som absorberar värme från det ursprungliga vattnet för att smälta och bli vatten.
- Sedan beräknas temperaturminskningen i det initiala vattnet, eftersom det har gett värme (QCED<0) para fundir el hielo.
- Slutligen måste smält vatten (från is) vara termiskt balanserat med vattnet som fanns initialt.
-
 Figur 4. Övning 3 Lösning. Källa: Självgjord.
Figur 4. Övning 3 Lösning. Källa: Självgjord.
Låt oss beräkna den värme som krävs för sammansmältningen av is:
Qf = l * mh = 333,5 kJ/kg * 0,025 kg = 8 338 kJ
Sedan är värmen som tilldelats av vattnet för att smälta isen qced = -qf
Denna värme som tilldelats av vattnet sjunker temperaturen till ett t 'värde som vi kan beräkna enligt följande:
T '= t0 - qf/(ma*ca) = 22,02 ° C
Där Ca är värmekapaciteten för vatten: 4,18 kJ/(kg ° C).
Slutligen kommer den ursprungliga vattenmassan som nu är vid 22,02 ° C att ge värme till det smälta vattnet från isen som är vid 0 ° C.
Slutligen kommer jämviktstemperaturen att nås efter tillräckligt med tid:
TE = (MA * T ' + MH * 0 ° C) / (MA + MH) = (0,25 kg * 22,02 ° C + 0,025 kg * 0 ° C) / (0,25 kg + 0,025 kg).
Slutligen erhåller jämviktstemperaturen:
TE = 20,02 ° C.
-Övning 4
En 0,5 kg blybit lämnar ugnen vid en temperatur av 150 ° C, vilket ligger ganska under dess smältpunkt. Den biten placeras i en behållare med 3 liter vatten vid rumstemperatur på 20 ° C. Bestäm den slutliga jämviktstemperaturen.
Beräkna också:
- Mängden värme som levereras med bly till vatten.
- Mängden värme som absorberas av vatten.
Data:
Specifik blyvärme: Cp = 0,03 kalk/(g ° C); Specifik vattenvärme: Ca = 1 lime/(g ° C).
Lösning
För det första bestämmer vi den slutliga jämviktstemperaturen TE:
TE = (MA CA TA + MP CP TP) / (MA CA + MP CP)
TE = 20,65 ° C
Då är mängden värme som tilldelats av bly:
QP = MP CP (TE - TP) = -1,94 x 10³ kalk.
Mängden värme som absorberas av vatten kommer att vara:
Qa = ma ca (te - ta) = +1,94x 10³ kalk.
Referenser
- Atkins, s. 1999. Fysisk kemi. Omega -utgåvor.
- Bauer, w. 2011. Fysik för teknik och vetenskap. Volym 1. MC Graw Hill.
- Giancoli, D. 2006. Fysik: Principer med applikationer. 6: e ... Ed Prentice Hall.
- Hewitt, Paul. 2012. Konceptuell fysisk vetenskap. Femte. Ed. Pearson.
- Resnick, r. (1999). Fysisk. Vul. 1. 3: e upplagan. på spanska. Kontinentala redaktionella företag s.TILL. av C.V.
- Rex, a. 2011. Fysikens grunder. Pearson.
- Sears, Zemansky. 2016. Universitetsfysik med modern fysik. 14th. Ed. Volym 1.
- Serway, R., Jewett, J. (2008). Fysik för vetenskap och teknik. Volym 1. 7th. Ed. Cengage Learning.
- « Kontinuerliga produktionssystemegenskaper, fördelar, exempel
- Ecuador liberala revolution orsakar, utveckling och konsekvenser »

