Struktur tenn, egenskaper, erhållning, användning

- 772
- 92
- Erik Eriksson
han tenn Det är en metall som tillhör blocket p av periodiska tabellen, vars kemiska symbol är SN, och som ligger i grupp 14, kolet. Trots att den är en allmänt använt metall i hela mänskligheten sedan forntiden är sanningen att det är en knapp metall i jordskorpan (2.3 ppm).
Det är en silver, mjuk, duktil och formbar metall. Den har ett atomantal på 50, och dess dominerande tillstånd eller oxidationsnummer är +2 (SN2+) och +4 (Sn4+), Att vara föreningarna med tenn (ii), till exempel SNCL2, Bra reducerande agenter.
 Alotroper. Källa: Zinn_9.JPG: Från: Användare: Tomihahndorf.Derivatarbete: MaterialScientist/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/2.0)
Alotroper. Källa: Zinn_9.JPG: Från: Användare: Tomihahndorf.Derivatarbete: MaterialScientist/CC BY-S (https: // CreativeCommons.Org/licenser/BY-SA/2.0) Tennet har som en symbol SN, som är en förkortning av det latinska ordet "Stannum". Tenn är en metallbeständig mot vattenattack och luft vid rumstemperatur; Men i varmluft bildar tenndioxid, snam2.
Egenskapen att vara resistent mot korrosion och ha en låg smältpunkt har tjänat till att ha många applikationer; såsom beläggning av metallytor och svetsning.
Tennet har två huvudsakliga allotropiska former: den vita och solida p -formen; och a, grå och normalt dammiga sammanhang (mer spröda). Därför är ß -formuläret det mest som används i tennapplikationer.
En annan viktig egenskap av tenn är dess förmåga att vara en del av legeringar med flera metaller, den äldsta är brons, en legering av koppar och tenn.
[TOC]
Upptäckt
 Tenngranuler. Källa: Nephronus, CC0, via Wikimedia Commons
Tenngranuler. Källa: Nephronus, CC0, via Wikimedia Commons Tenn är en metall som är känd sedan forntida tider. Därför är det inte känt vem hans upptäckare var; Och mycket mindre, året och platsen för dess upptäckt.
Brons är en legering av koppar med tenn och arsenik. Det är möjligt att utarbetandet av denna legering är en följd av ett lyckligt och oavsiktligt faktum, eftersom de första bronsobjekten - i bronsåldern - bildades av koppar och endast arseniska spår.
Dessa föremål dök upp i Nära öst där arsenik är associerad med koppar. Men från början bevisades arsenikens toxicitet och uppnådde dess ersättning2).
De gamla grekerna erhöll tenn genom maritim handel och hänvisade till källan till deras tenn som "kassiteriderna" som betyder "tennöar". Det är möjligt att dessa öar var belägna i Cornuelles, British eller Spanien, där det finns stora tennavlagringar.
Det kan tjäna dig: vismut subsalicylat: struktur, egenskaper, användningar, effekterKemisk tennstruktur
När det finns två alotroper: den vita tenn eller ß-SN och den gråa tenn eller a-SN, kommer vi att ha två kristallina strukturer. P-SN är tetragonal centrerad på kroppen (BCT), som kännetecknar den vita tennens formbarhet.
Samtidigt är strukturen för a-SN diamant; Det vill säga SN -atomerna är kopplade till bildande av tetrahedra -nät, utan att det finns en metallbindning alls.
Tennet presenterar också två andra alotroper under olika tryckförhållanden (i ordningen av GPA) och temperatur (över 161 ºC): σ-SN och y-SN.
Elektronisk konfiguration
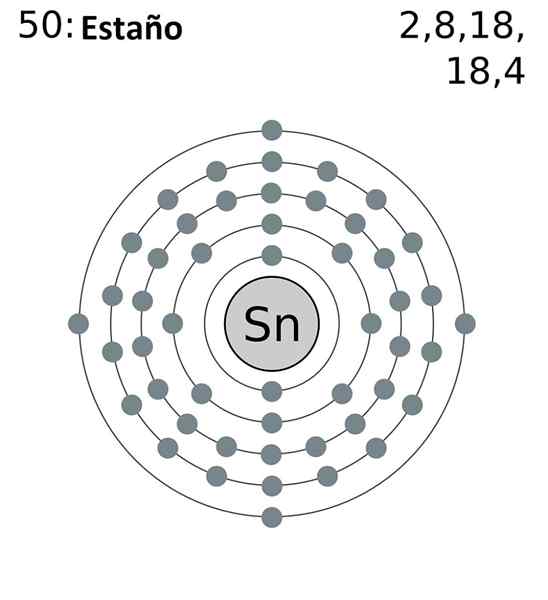
Den förkortade elektroniska konfigurationen är som följer:
[KR] 4d10 5S2 5 p2
Lägga till alla elektroner kommer vi att ha totalt 14, samma nummer som motsvarar din grupp. Emellertid är bara elektronerna i 5S- och 5P -orbitalerna de som deltar i tennens kemiska reaktioner, eftersom de för 4D inte är energiskt tillgängliga.
Tennegenskaper
Utseende och fysiska egenskaper
Tenn är en mjuk, duktil och formbar metall, som kan vara kall och snurrande. Dess låga smältpunkt gör det möjligt att fästa för att rengöra ytor av metaller eller legeringar såsom stål, koppar och dess legeringar och skyddar dem från oxidation.
När en tennstycke är vikta, skär det och avger ett karakteristiskt ljud som kallas "tenn rop", en konsekvens av kristallernas krossning.
Tenn har två allotropiska former: ß och a. Ss -formen motsvarar ett vitt fast ämne och ansvarar för tennapplikationer; Medan a -formen är ett gråaktigt pulver.
 Tennplats i det periodiska bordet. Källa: Bild av Daniel Mayer eller Greatpatton och släpps under GNU FDL
Tennplats i det periodiska bordet. Källa: Bild av Daniel Mayer eller Greatpatton och släpps under GNU FDL Ss -formen presenteras vid temperaturer över 13.2 ºC. När temperaturen sjunker 13.2 ºC, tennändringar från ß -form till a -formuläret. Detta fenomen är oönskat och undviks genom att lägga till andra metaller till tenn, till exempel antimon eller vismut, som blockerar denna förändring och förlängning av dess användbara liv.
Tin är den första superledaren känd vid temperaturer under 3.72 K.
Atomnummer
femtio
Molmassa
118.71 g/mol
Smältpunkt
231.93 ºC
Kokpunkt
2602 ºC
Densitet
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Oxidationstillstånd
Tin har flera oxidationstillstånd: -4, -3, -2, -1, 0, +1, +2, +3, +4. Men de flesta av deras föreningar har tennet med oxidationstillstånd +2 (SN2+) och +4 (Sn4+).
Kan tjäna dig: organiska föreningarJoniseringsenergier
Första: 708.6 kJ/mol
Andra: 1411.8 kJ/mol
Tredje: 2943.0 kJ/mol
Elektronnegativitet
1.96 på Pauling -skalan
Reaktivitet
Tenn är en metallbeständig mot luft- och vattenverkan vid rumstemperatur, men när den värms upp i luften bildar tennoxid (iv), snam2, vilket är svagt surt. Det attackeras av syror och alkalier, och i närvaro av syre kan i vissa fall verka som en katalysator.
Erhållande
 Casiterite Mineral är den viktigaste tennmineralogiska källan. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0)
Casiterite Mineral är den viktigaste tennmineralogiska källan. Källa: Rob Lavinsky, irocks.com-cc-by-sa-3.0/CC BY-SA (https: // Creativecommons.Org/licenser/BY-SA/3.0) Tennet, ur synvinkeln för dess förekomst, är en sällsynt metall, eftersom den har ett överflöd i jordens bark på bara 2 ppm. Casiterite Mineral, ett tennoxidmineral, är den enda kommersiella källan.
Casiterite är ett svartaktigt mineral som finns i leriga grunder på flodernas strand. Tennet extraheras från casiteriten genom att värma upp till 1370 ºC med kol eller koks för att producera dess minskning.
Den producerade tennen är oren, så den behandlas med natriumhydroxid eller saltsyra för att solubilisera tenn. Sedan utsätts detta för elektrolys, som är tennanoden och järnkatoden. Tennet deponeras på katoden, med en renhet större än 90%.
Användning/applikationer
Rostskydd
Tenn är korrosionsbeständig metall. Den så kallade burk eller tenn är en stålbehållare, täckt med ett tennlager för att undvika oxidation.
Burkarna har använts för att lagra mat och andra ämnen, till exempel: målningar, lack, lösningsmedel etc. Men de ersätts för närvarande av aluminium- eller plastbehållare. Tin -belagda rör och ventiler upprätthåller vatten och dryck renhet.
Legeringar
 De första användningarna för tennlegeringar var att tillverka containrar eller redskap som burkar och kannor i detta skafferi. Källa: Butterfly Voyages - Serge Ouachée/CC av -SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0)
De första användningarna för tennlegeringar var att tillverka containrar eller redskap som burkar och kannor i detta skafferi. Källa: Butterfly Voyages - Serge Ouachée/CC av -SA (https: // CreativeCommons.Org/licenser/BY-SA/3.0) Mannen började använda brons i mer än 5000 år. Brons är en legering av koppar och tenn som används vid utarbetande av verktyg, vapen, hushållsredskap.
På samma sätt användes skalet, en legering som ursprungligen var av tenn och bly, för att tillverka krukor, plattor etc. Men på grund av ledtoxicitet tillverkas Peel för närvarande med tenn-, antimon- och koboltlegering.
Det kan tjäna dig: Hypoyodous Acid (HIO)Tennlegeringen och blyet har en låg smältpunkt, egenskap som har tillåtit att använda vid svetsning, en teknik som tjänar till att sätta ihop bitar som finns i elektriska och elektroniska kretsar. Det finns bilar där tennlegeringen med järn, medan de används i flyg- och rymdfordon aluminium, tenn och titanlegeringar.
Cirkoniumlegeringar, även kallade zirkaloys, används i kärnreaktorer och har en liten mängd tenn.
 Tennprover. Källa: Ondřej Mangl, allmän domän, via Wikimedia Commons
Tennprover. Källa: Ondřej Mangl, allmän domän, via Wikimedia Commons Legeringen av silver och tenn har använts i tandamalgamer.
En kristallin legering med Niobio -elementet är en superledare som arbetar vid en temperatur av 18 K och upprätthåller sin egendom i ett starkt magnetfält.
Glas
Tennet används i Pilkington -proceduren för att producera fönsterglas. Det smälta glaset placeras på en smält tennytan och förvärvar glaset en platt och slät yta. Denna teknik används fortfarande framgångsrikt.
Tennsalter sprayas på glaset för att få ett ledande kraftfoder, att kunna använda för att tillverka belysningspaneler och vindrutan utan frost.
Tennföreningar
Syndig klorid (SNCL2) Det används i tenngalvaniserat och som reducerande medel vid tillverkning av polymerer och färgämnen. Tennfluorid (SNF2) Det är en aktiv ingrediens i tandpasta.
Samtidigt är dess oxid en användbar katalysator i vissa industriella processer. Dessutom används det som pulver för att polera stål.
Organiska tennföreningar används som biocider och fungicider, som är giftiga för människor. Organiska tennstabilisatorer används för att förhindra förändringar i polyvinylklorid på grund av exponering för ljus och värme.
Kloriden isñico (SNCL4) används som parfymstabilisator och som utgångsmaterial för andra tennsalter.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (fjärde upplagan). MC Graw Hill.
- Wikipedia. (2020). Tenn. Hämtad från: i.Wikipedia.org
- National Center for Biotechnology Information (2020). Tenn. Pubchem Comunund -sammanfattning för CID 23974. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Doktor. Doug Stewart. (2020). Tennelement fakta. Återhämtat sig från: Chemicool.com
- Redaktörerna för Enyclopaedia Britannica. (2020). Tenn. Återhämtat sig från: Britannica.com
- Klocka, Terence. (26 augusti 2020). Egenskaper, produktion och tillämpningar av tenn. Återhämtat sig från: tankco.com
- Lentech B.V. (2020). Tenn. Återhämtat sig från: Lentech.com
- Stephanie Pupas. (28 juli 2015). Fakta om tenn. Återhämtat sig från: Livescience.com
- AIP -konferensförfaranden. (9 februari 2018). Tennåtervinning från tennslagg med elektrolysmetod. doi.org/10.1063/1.5024070

