Kvaternär struktur av egenskaperproteiner
- 4272
- 1
- Anders Larsson
De Kvartärstruktur av proteiner Definierar rumsliga relationer mellan var och en av dess underenheter av polypeptider kopplade av icke -kovalenta krafter. I polymerproteiner kallas var och en av polypeptidkedjorna som utgör den underenheter eller protomerer.
Proteiner kan bildas av en (monomer), två (dimérica), flera (oligomera) eller många protomerer (polymer). Dessa protomerer kan ha en liknande eller mycket annan molekylstruktur mellan dem. I det första fallet sägs det att de är homotypiska proteiner och i det andra fallet, heterotypiskt.
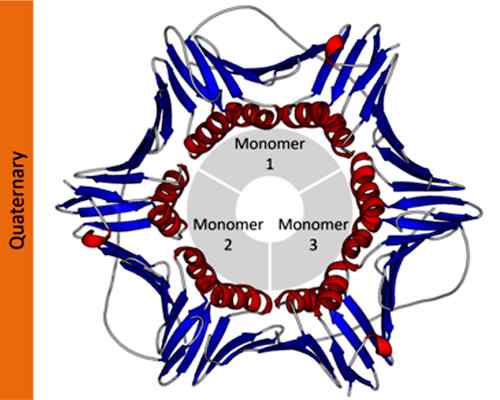
 Exempel på en kvartärstruktur av en proliferationscellens kärnantigenprotein. Tagen och redigerad från: Thomas Shafee [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)].
Exempel på en kvartärstruktur av en proliferationscellens kärnantigenprotein. Tagen och redigerad från: Thomas Shafee [CC av 4.0 (https: // CreativeCommons.Org/licenser/av/4.0)]. I vetenskaplig notation använder biokemister grekiska bokstäver med abonnemang för att beskriva sammansättningen av proteinprotomerer. Till exempel betecknas ett tetrameriskt homotypiskt protein som a4, Medan ett tetrameriskt protein bildat av två olika dimerer betecknas som a2p2.
[TOC]
Proteinstruktur
Proteiner är komplexa molekyler som förvärvar olika tre -dimensionella konfigurationer. Dessa konfigurationer är exklusiva för varje protein och gör att de kan utföra mycket specifika funktioner. Nivåerna för strukturell organisation av proteiner är följande.
Primärstruktur
Den hänvisar till sekvensen där de olika aminosyrorna i polypeptidkedjan är ordnade. Denna sekvens ges av DNA -sekvensen som kodar för sådant protein.
Sekundärstruktur
De flesta proteiner är inte långa kedjor av helt utökade aminosyror, men har regioner som regelbundet är vikta i form av propeller eller ark. Denna vikning är den som kallas sekundärstruktur.
Tertiärstruktur
De vikta områdena i den sekundära strukturen kan i sin tur fälla och montera i mer kompakta strukturer. Denna sista vikning är den som ger proteinet sin tre -dimensionella form.
Kvartärstruktur
I de proteiner som bildas av mer än en underenhet är de kvartära strukturerna de rumsliga förhållandena som finns mellan varje underenhet, som är kopplade av icke -kovalenta bindningar.
Kan tjäna dig: hur svamp andas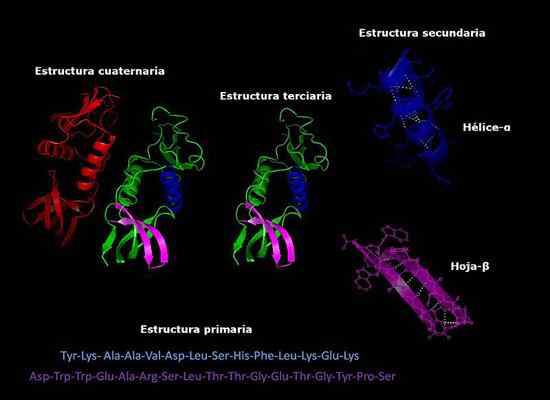 Primär, sekundär, tertiär och kvartära strukturer av proteiner, tre -dimensionell konformation. Tagen och redigerad från: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Primär, sekundär, tertiär och kvartära strukturer av proteiner, tre -dimensionell konformation. Tagen och redigerad från: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Stabilitet i den kvartära strukturen
Den tre dimensionella strukturen hos proteiner stabiliseras av svaga eller icke -kovalenta interaktioner. Medan dessa länkar eller interaktioner är mycket svagare än vanliga kovalenta bindningar, är dessa många och deras kumulativa effekt är kraftfull. Därefter kommer vi att se några av de vanligaste interaktionerna.
Hydrofoba interaktioner
Vissa aminosyror innehåller hydrofoba sidokedjor. När proteiner har dessa aminosyror beställer vikningen av molekylen dessa sidokedjor i proteinet och skyddar dem från vatten. Arten av de olika sidokedjorna får dem att bidra på olika sätt i den hydrofoba effekten.
Van der Waals interaktion
Dessa interaktioner inträffar när molekyler eller atomer som inte är förenade genom kovalenta bindningar närmar sig för mycket mellan dem, och på grund av detta börjar deras yttersta elektroniska orbitaler överlappa varandra.
Vid den tiden upprättas en avstötningskraft mellan dessa atomer som växer mycket snabbt när deras respektive centra ungefär. Dessa är de så kallade van der Waals "styrkor".
Interaktioner
Det är den elektrostatiska interaktionen som inträffar mellan ett par laddade partiklar. I proteiner förekommer denna typ av interaktioner, både på grund av proteinets näteladdning, och den individuella belastningen av jonerna inuti inuti. Denna typ av interaktioner kallas ibland Puente Salino.
Vätebindningar
En vätebindning upprättas mellan en bifogad väteatom, med hjälp av medel.
Denna typ av bindning är mycket viktig, eftersom egenskaperna hos många molekyler, inklusive vatten- och biologiska molekyler, till stor del beror på vätebindningar. Dela egenskaper hos kovalenta bindningar (elektroner delas) och även av icke-kovalenta interaktioner (last-belastningsinteraktion).
Kan tjäna dig: övergående grödorDipolos -interaktioner
I molekyler, inklusive proteiner, som inte presenterar nettobelastning, kan en icke -enhetlig disposition av deras interna belastningar skickas in, med ett lite mer negativt slut än ett annat. Detta är vad som kallas en dipol.
Detta dipoltillstånd för molekylen kan vara permanent, men den kan också induceras. Dipolos kan lockas till joner eller andra dipoler. Om dipolerna är permanenta har interaktionen större omfattning än som presenteras med inducerade dipoler.
Förutom dessa icke -kovalenta interaktioner stabiliserar vissa oligomera proteiner sin kvartära struktur med hjälp av en kovalent länktyp, disulfidlänken. Dessa är etablerade mellan sulfhydrillogrupperna i cysteonerna i olika protomerer.
Disulfurobindningar hjälper också till att stabilisera den sekundära strukturen för proteiner, men i detta fall ansluts cysteinavfall inuti samma polypeptid (intrapopolipeptiddisulfidlänkar).
Interaktioner mellan protomerer
Som nämnts tidigare, i proteiner som består av flera underenheter eller protomerer, kan dessa underenheter vara liknande (homotypiska) eller olika (heterotypiska).
Homotypiska interaktioner
Underenheterna som utgör ett protein är asymmetriska polypeptidkedjor. I homotypiska interaktioner kan emellertid dessa underenheter associeras på olika sätt att uppnå olika typer av symmetri.
De grupper som interagerar med varje protomere finns i allmänhet i olika positioner, så de kallas heterologa interaktioner. Heterologa interaktioner mellan de olika underenheterna förekommer ibland på ett sådant sätt att varje underenhet är krokig med avseende på föregången, en spiralformad struktur och en spiralformad struktur.
Vid andra tillfällen ges interaktioner på ett sådant sätt att definierade underenheter är ordnade runt en eller flera symmetriaxlar, i det som kallas punkt - gruppsymmetri. När det finns flera symmetrixlar bryts varje underenhet med avseende på dess 360 °/N -granne (där N representerar antalet axlar).
Det kan tjäna dig: australiensiska flora och fauna: representativa arterBland de typer av symmetri som erhålls på detta sätt är till exempel spiralformade, kubiska och icosahedrala.
När två underenheter interagerar genom en binär axel bröts varje enhet 180 ° med avseende på den andra, runt den axeln. Denna symmetri kallas symmetri c2. I den är interaktionsplatserna i varje underenhet identiska; I det här fallet är det inget samtal om heterologinteraktion, utan om en isologisk interaktion.
Om, tvärtom, sambandet mellan de två komponenterna i dimeren är heterolog, kommer en asymmetrisk dimer att erhållas.
Heterotypiska interaktioner
Inte alltid underenheterna som interagerar i ett protein är av samma natur. Det finns proteiner som bildas av tolv eller fler olika underenheter.
Interaktioner som upprätthåller proteinets stabilitet är desamma som i homotypiska interaktioner, men helt asymmetriska molekyler erhålls vanligtvis.
Hemoglobin är till exempel en testare som presenterar två par olika underenheter (a2p2).
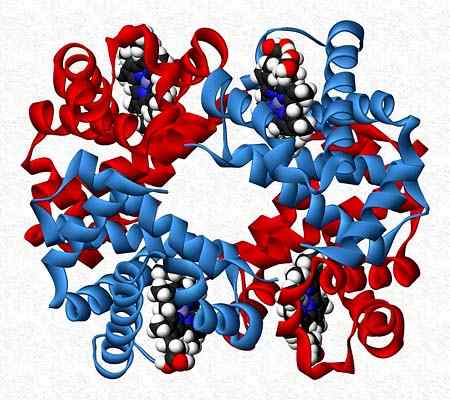 Kvartärstruktur av hemoglobin. Tagen och redigerad från: Benjah-Bmm27. Modifierad av Alejandro Porto. [CC0].
Kvartärstruktur av hemoglobin. Tagen och redigerad från: Benjah-Bmm27. Modifierad av Alejandro Porto. [CC0]. Referenser
- C.K. Mathews, K.OCH. Van Hold & K.G. Ahern (2002). Biokameri. Tredje upplagan. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, s. Mayes, D.C. Granner & V.W. Rodwell (1996). Harpers biokameri. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (2002). Biokameri. Femte upplagan. W. H. Frigöring.
- J. Koolman & K.-H. Roehm (2005). Atlas av biokemi färg. 2: a upplagan. Thiem.
- TILL. Lehninger (1978). Biokemi. Omega -utgåvor, s.TILL.
- L. Stryer (1995). Biokameri. W.H. Freeman and Company, New York.
- « 1800 -talet i Chile Population, Society, Economy and Politics
- Vimentinegenskaper, struktur, funktioner och användningsområden »

