Funktionens primärstruktur
- 4518
- 1359
- Erik Eriksson
De primärstruktur av proteiner Det är i vilken ordning aminosyrorna i polypeptiderna som omfattar är ordnade. Ett protein är en biopolymer bildad av a-aminosyramonomerer förenade genom peptidbindningar. Varje protein har en bestämd sekvens av dessa aminosyror.
Proteiner utför en enorm mångfald av biologiska funktioner, inklusive form och upprätthåller cellernas integritet genom cytoskelett, försvara kroppen av konstiga medel genom antikroppar och katalysera de kemiska reaktionerna i organismen genom enzymer.
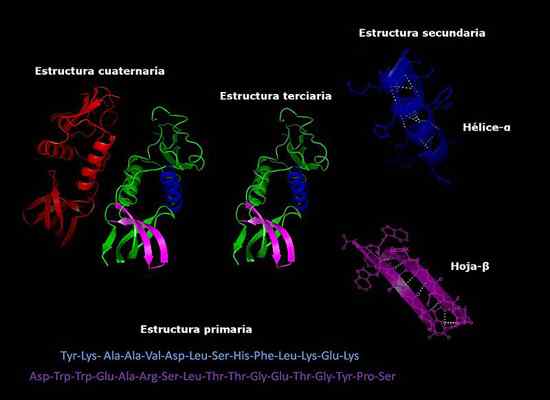
 Primär, sekundär, tertiär och kvartära strukturer av proteiner, tre -dimensionell konformation. Tagen och redigerad från: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Primär, sekundär, tertiär och kvartära strukturer av proteiner, tre -dimensionell konformation. Tagen och redigerad från: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. För närvarande är bestämningen av sammansättningen av proteiner och ordningen i vilken aminosyror (sekvensering) är arrangerade snabbare än år sedan. Denna information deponeras i internationella elektroniska databaser, som kan nås via Internet (GenBank, PIR, bland andra).
[TOC]
Aminosyror
Aminosyror är molekyler som innehåller en aminogrupp och en karboxylsyragrupp. När det gäller a-aminosyror har de en central kolatom (kol a) som de är förenade, både aminogruppen och karboxylgruppen, förutom en väteatom och en distinkt R-grupp, som kallas sida kedja.
På grund av denna konfiguration av a-kol är aminosyrorna som bildas, kända som a-aminosyror, chiraler. Det finns två former som är spegelbilder av varandra och som kallas enantiomerer L och D.
Allt protein av levande varelser bildas av 20 a-aminosyrakonfiguration L. Sidokedjorna av dessa 20 aminosyror är olika och har en stor mångfald av kemiska grupper.
I grund och botten kan a-aminosyror grupperas (godtyckligt) beroende på typ av sidokedja på följande sätt.
Alifatiska aminosyror
I denna grupp finns de enligt vissa författare glycin (GLI), alanin (vinge), valin (Val), leucina (leu) och isoleucin (ILE). Andra författare inkluderar också Metionine (Met) och Proline (Pro).
Kan tjäna dig: fosfolipider: egenskaper, struktur, funktioner, typerAminosyror med sidokedjor som innehåller hydroxyl eller svavel
Den innehåller serinen (Ser), cystein (Cys), Treonina (THR) och även mätning. Enligt vissa författare bör gruppen bara inkludera varelse och Thr.
Cykliska aminosyror
Integrerad endast av prolinen, som, som redan påpekats, ingår av andra författare bland alifatiska aminosyror.
Aromatiska aminosyror
Fenylalanin (PHE), tyrosin (Tyr) och Triphafano (TRP).
Grundläggande aminosyror
Histidine (His), Lysine (Lys) och Arginina (ARG)
Sura aminosyror och dess amider
Den innehåller aspartinsyror (ASP) och glutamiska (Glu) och även Aspargin (ASN) och glutamin (GLN). Vissa författare separerar den senare gruppen i två; Å ena sidan den av sura aminosyror (de första två), och å andra sidan de som innehåller karboxylamid (de återstående två).
Peptidlänkar
Aminosyror kan gå med varandra genom peptidlänkar. Dessa länkar, även kallade amida-länkar, är etablerade mellan a-amino-gruppen av en aminosyra och a-karboxylgruppen hos en annan. Denna fackförening bildas med förlusten av en vattenmolekyl.
Föreningen mellan två aminosyror resulterar i bildandet av en dipéptid, och om nya aminosyror tillsätts, i följd, tripid, tetrapéptider och så vidare.
Polypeptiderna som bildas av ett litet antal aminosyror, får det allmänna namnet på oligopeptider, och om antalet aminosyror är högt, kallas polypeptider.
Varje aminosyra som tillsätts i polypeptidkedjan frigör en vattenmolekyl. Den del av aminosyran som har tappat H+ eller OH- under unionen kallas resten av aminosyran.
De flesta av dessa oligopeptid- och polypeptidkedjor kommer i ena änden att presentera en aminoterminal (N-terminal) grupp, och i den andra en terminal karboxyl (C-terminal). Utöver detta kan de innehålla många joniserbara grupper mellan sidokedjorna i aminosyravfallet som omfattar dem. På grund av detta övervägs polyanfoliter.
Kan tjäna dig: Flora och Fauna of Campeche: Representativa arter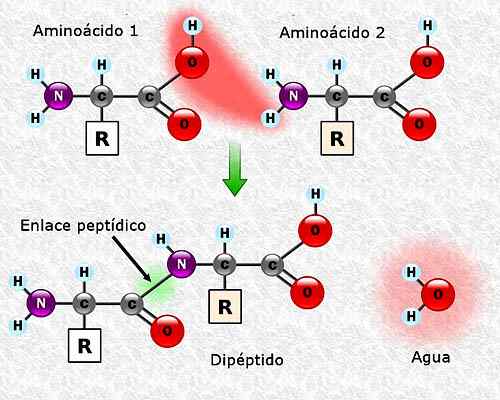 Bildning av en peptidlänk mellan två aminosyror. Tagen och redigerad från: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)].
Bildning av en peptidlänk mellan två aminosyror. Tagen och redigerad från: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]. Aminosyrasekvens
Varje protein har en viss sekvens av sitt aminosyravfall. Denna ordning är det som kallas proteinets primära struktur.
Varje enskilt protein av varje organisme är specifikt för arten. Det vill säga myoglobin hos en människa är identisk med den hos en annan människa, men har små skillnader med myoglobinerna hos andra däggdjur.
Mängden och typerna av aminosyror som ett protein innehåller är lika viktigt som platsen för dessa aminosyror i polypeptidkedjan. För att känna till proteinerna måste biokemister först isolera och rena varje speciellt protein, sedan göra en analys av aminosyran och slutligen bestämma dess sekvens.
För att isolera och rena proteiner finns det olika metoder, bland vilka är: centrifugering, kromatografi, gelfiltrering, dialys och ultrafiltrering, såväl som användningen av proteinlöslighetsegenskaper som studeras i studie.
Bestämningen av aminosyrorna som finns i proteinerna utförs efter tre steg. Den första är att bryta peptidbindningarna genom hydrolys. Därefter separeras de olika typerna av aminosyror från blandningen; Och slutligen kvantifieras var och en av de typer av erinerade aminosyror.
För att bestämma proteinets primära struktur kan olika metoder användas; Men för närvarande den mest använda är Edmans metod, som i princip består av märkning och separering av den N-terminala aminosyran från resten av kedjan upprepade gånger och identifierar varje aminosyran som frigörs individuellt.
Proteinkodning
Den primära strukturen för proteiner är kodad i organismgener. Genetisk information finns i DNA, men för proteinöversättning måste först transkriberas till RNM -molekyler. Varje nukleotid triplett (kodon) kodar för en aminosyra.
Kan tjäna dig: vad är den kemiska sammansättningen av levande varelser?Eftersom det finns 64 möjliga kodoner och endast 20 aminosyror används vid konstruktion av proteiner, kan varje aminosyra kodas av mer än en kodon. Praktiskt taget alla levande varelser använder samma kodoner för att koda samma aminosyror. Därför betraktas den genetiska koden som ett nästan universellt språk.
I den här koden finns det kodoner som används för att starta och också stoppa polypeptidöversättning. Slutförda kodon kodar inte någon aminosyra, utan stoppar översättningen till kedjan C-terminal och representeras av UAA, UAG och UGA-tripletter.
Å andra sidan fungerar AUG -kodonet normalt som en startsignal och kodar också mätningen.
Efter översättning kan proteiner drabbas av en viss bearbetning eller modifiering, såsom kort, för att uppnå sin definitiva konfiguration.
Referenser
- C.K. Mathews, K.OCH. Van Hold & K.G. Äktare. 2002. Biokameri. 3th Utgåva. Benjamin / Cummings Publishing Company, Inc.
- Murray, s. Mayes, D.C. Granner & V.W. Rodwell. nitton nittiosex. Harpers biokameri. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & l. Stryer (SF). Biokameri. 5th Utgåva. W. H. Frigöring.
- J. Koolman & K.-H. Roehm (2005). Atlas av biokemi färg. 2Och Utgåva. Thiem.
- TILL. Lehninger (1978). Biokemi. Omega -utgåvor, s.TILL.
- L. Stryer (1995). Biokameri. W.H. Freeman and Company, New York.
- « Avogadro -nummerhistoria, enheter, hur det beräknas, använder användningar
- Exonukleasegenskaper, struktur och funktioner »

