Rutherford experimenthistoria, beskrivning och slutsatser
- 2918
- 198
- Anders Larsson
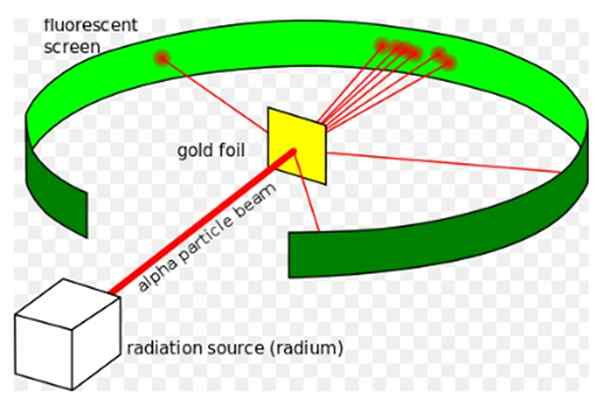
han Rutherford -experiment, Den genomfördes mellan 1908 och 1913, den bestod av att bombardera ett tunt guldark på 0.0004 mm tjockt, med alfa -partiklar och analysera spridningsmönstret som dessa partiklar lämnade på en lysrörsskärm.
Egentligen genomförde Rutherford många experiment och förfina detaljerna mer och mer. Efter att ha noggrant analyserat resultaten avslöjades två mycket viktiga slutsatser:
-Atomens positiva belastning är koncentrerad i en region som heter kärna.
-Denna atomkärna är oerhört liten jämfört med atomens storlek.
 Figur 1. Rutherfords experiment. Källa: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)]
Figur 1. Rutherfords experiment. Källa: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenser/BY-SA/3.0)] Ernest Rutherford (1871-1937) var en fysiker född i Nya Zeeland, vars intresseområde var radioaktivitet och natur av materia. Radioaktivitet var ett nyligen fenomen när Rutherford började sina experiment, det hade upptäckts av Henri Becquerel 1896.
1907 flyttade Rutherford till University of Manchester i England för att studera atomens struktur och använde dessa alfapartiklar som sonder för att granska det inre av en sådan liten struktur. Fysiker Hans Geiger och Ernest Marsden åtföljde honom i uppgiften.
De höll hoppet på att se hur en alfapartikel, som är en dubbeljoniserad heliumatom, interagerade med en unik guldatom, för att säkerställa att varje avvikelse som den upplevde endast berodde på den elektriska kraften.
De flesta av alfapartiklarna korsade emellertid guldarket bara en liten avvikelse.
Detta faktum var i total överensstämmelse med Thomsons atommodell, dock till forskarnas överraskning, en liten andel av alfapartiklar upplevde en ganska anmärkningsvärd avvikelse.

Och en ännu mindre procentandel av partiklarna returnerade, studsar helt bakåt. Varför var dessa oväntade resultat?
[TOC]
Beskrivning och slutsatser från experimentet
Faktum är att alfapartiklarna som Rutherford använde som sond, är heliumkärnor, och vid den tiden var det bara känt att dessa partiklar hade positiv laddning. Idag är det känt att alfapartiklar består av två protoner och två neutroner.
Alfa- och beta -partiklar hade identifierats av Rutherford som två olika slags strålning från uran. Alfapartiklar, mycket mer massiva än elektronen, har positiv elektrisk laddning, medan betapartiklar kan vara elektroner eller positroner.
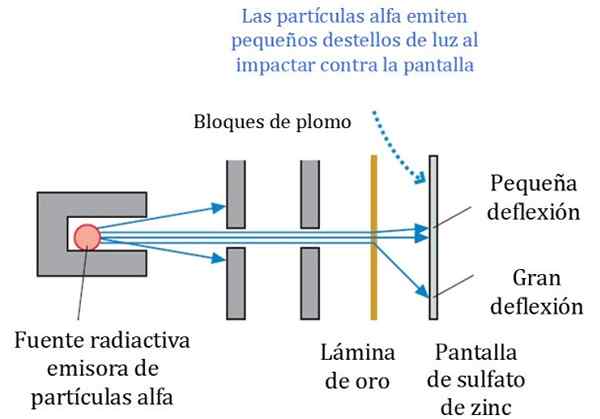 figur 2. Detaljerat schema för Rutherford, Geiger och Marsden Experiment. Källa: R. Riddare. Fysik för forskare och teknik: En strategistrategi. Pearson.
figur 2. Detaljerat schema för Rutherford, Geiger och Marsden Experiment. Källa: R. Riddare. Fysik för forskare och teknik: En strategistrategi. Pearson. Figur 2 visar ett förenklat schema för experimentet. Alfapartikelstrålen kommer från en radioaktiv källa. Geiger och Marsden använde radongas som en emitter.
Blyblock användes för att rikta strålningen till guldarket och förhindra dem från att stoppa direkt till den fluorescerande skärmen. Bly är ett material som absorberar strålning.
Kan tjäna dig: Centrioles: Funktioner och egenskaperSedan påverkades den riktade strålen således på ett tunt guldark och de flesta av partiklarna följer sig till den lysrörssulfatskärmen, där de lämnade ett litet lätt fotavtryck. Geiger var ansvarig för att räkna dem en efter en, även om de sedan designade en enhet som gjorde det.
Det faktum att vissa partiklar upplevde en liten avböjning överraskade inte Rutherford, Geiger och Marsden. När allt kommer omkring, i atomen finns det positiva och negativa laddningar som utövar styrka på alfapartiklar, men eftersom atomen är neutral, vilket de redan visste, bör avvikelserna vara små.
Experimentets överraskning är att några positiva partiklar hoppades nästan direkt.
Slutsatser
Cirka 1 av 8000 alfapartiklar upplevde avböjning i vinklar större än 90º. Få, men tillräckligt för att ifrågasätta några saker.
Atommodellen i Boga var den av Thomsons pudin, före detta Rutherford -professor vid Cavendish Laboratory, men han undrade om idén om en atom utan kärna och med elektronerna inbäddade som russin var det korrekt.
Eftersom det visar sig att denna stora avböjning av alfapartiklarna och det faktum att ett fåtal kan återvända kan det bara förklaras om en atom har en liten, tung och positiv kärna. Rutherford antog att endast krafterna för elektrisk attraktion och avstötning, som anges i Coulombs lag, var ansvariga för alla avvikelser.
När några av alfapartiklarna direkt närmar sig kärnan och eftersom den elektriska kraften varierar med det omvända kvadratet på avståndet, känner de en avvisande som orsakar dem spridningen av stor vinkel eller avvikelsen bakåt.
För att säkerställa att Geiger och Marsden upplevde bombningsark med olika metaller, inte bara guld, även om denna metall var den mest lämpliga för deras formbarhet, att skapa mycket fina ark.
När Rutherford fick liknande resultat övertygade Rutherford att den positiva belastningen i atomen skulle vara belägen i kärnan och inte sprids i hela sin volym, som Thomson postulerade i sin modell.
Å andra sidan, som den stora majoriteten av alfapartiklar, hände det utan att avvika, kärnan bör vara mycket, mycket liten jämfört med atomstorleken. Men denna kärna var tvungen att koncentrera det mesta av atommassan.
Påverkan i atommodellen
Resultaten blev mycket förvånade över Rutherford, som förklarade på en konferens i Cambridge: "... Det är som när du skjuter en 15 -tums kanonkula mot ett ark silkpapper och projektilen studsar direkt till dig och träffar dig".
Kan tjäna dig: 10 funktioner i den teoretiska ramen för en utredningEftersom dessa resultat inte kunde förklaras av Thomsons atommodell föreslog Rutherford att atomen bildades av en kärna, mycket liten, mycket massiv och positivt belastad. Elektronerna förblev och beskriver banor runt dem, vilket solminiatyrsystem.
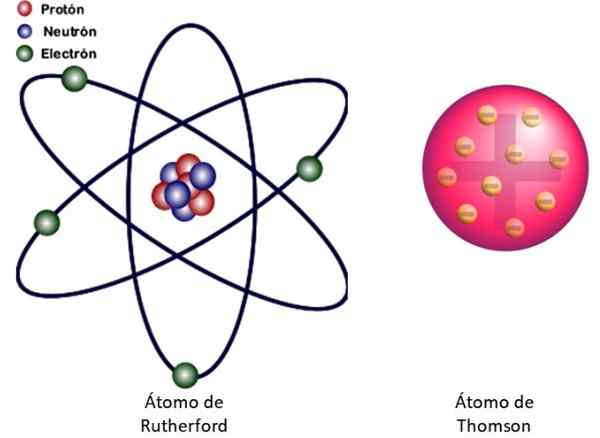 Figur 3. Till vänster den atomiska modellen i Rutherford och till höger Buddin -typen av Thomsons. Källa: Wikimedia Commons. Vänster bild: JCYMC90 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)]
Figur 3. Till vänster den atomiska modellen i Rutherford och till höger Buddin -typen av Thomsons. Källa: Wikimedia Commons. Vänster bild: JCYMC90 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] Detta är den kärnkraftsmodellen för atomen som visas i figur 3 till vänster. Eftersom elektroner är mycket, mycket små också, visar det sig att atomen nästan är allt .. . tömma! Därför korsar de flesta alfapartiklar arket utan att avvika bara.
Och analogin med ett miniatyrsolsystem är mycket framgångsrik. Atomarkärnan spelar solens roll, som innehåller nästan hela massan plus den positiva belastningen. Elektronerna går runt runt dem som planeterna och bär den negativa belastningen. Uppsättningen är elektriskt neutral.
Om fördelningen av elektroner i atomen visade Rutherfords experiment ingenting. Man kunde tro att alfapartiklar skulle ha viss interaktion med dem, men massan av elektroner är för liten och inte kunde avleda partiklarna signifikant.
Nackdelar i Rutherford -modellen
Ett problem med denna atommodell var precis beteendet hos elektroner.
Om dessa inte var statiska, utan att kretsa i atomkärnan i cirkulära eller elliptiska banor, regisserade av den elektriska attraktionen, skulle de hamna till kärnan.
Detta beror på att accelererade elektroner tappar energi, och om det händer skulle det vara atomens och materiens kollaps.
Lyckligtvis är detta inte vad som händer. Det finns en slags dynamisk stabilitet som undviker kollaps. Nästa atommodell, efter Rutherfords, var den av Bohr, som gav några svar på varför atomkollapsen inte inträffar.
Protonen och neutronen
Rutherford fortsatte att göra spridningsexperiment. Mellan 1917 och 1918 valde han och hans assistent William Kay att bomba.
Det blev förvånat igen, när man upptäckte vätekärnor. Detta är reaktionsekvationen, den första konstgjorda kärntransmutationen har aldrig uppnått:
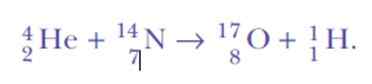 Tja, om alfa -partiklar är heliumkärnor, var kan vätekärnor komma ifrån?
Tja, om alfa -partiklar är heliumkärnor, var kan vätekärnor komma ifrån?
Svaret var: från samma kväve. Rutherford hade tilldelats väteatomisk nummer 1, för att vara det enklaste elementet av alla: en positiv kärna och en negativ elektron.
Rutherford hade hittat en grundläggande partikel som han kallade proton, ett namn härrörande från det grekiska ordet till först. På detta sätt är protonen en väsentlig beståndsdel i varje atomkärna.
Kan tjäna dig: volymSenare, 1920, föreslog Rutherford att det skulle finnas en neutral partikel och med en massa som är mycket lik protonen. Han kallade denna partikel neutron och är en del av nästan alla kända atomer. Fysiker James Chadwick identifierade det äntligen 1932.
Hur är en skalmodell av väteatomen?
Väteatomen är, som vi har sagt, det enklaste av alla. Det var dock inte lätt att utarbeta en modell för denna atom.
På varandra följande upptäckter gav upphov till kvantfysik och en hel teori som beskriver atomnivån fenomen. Under denna process utvecklades också atommodellen. Men låt oss se frågan om storlekar lite:
Väteatomen har en kärna bestående av en proton (positiv) och har en enda elektron (negativ).
Väteatomens radie har uppskattats till 2.1 x 10-10 m, medan protonen är 0.85 x 10 -femton m eller 0.85 femtometrar. Namnet på denna lilla enhet beror på Enrico Fermi och används mycket när du arbetar på denna skala.
Tja, kvoten mellan atomens radie och kärnan är i storleksordningen 105 M, det vill säga atomen är 100 000 gånger större än kärnan!.
Vi måste emellertid komma ihåg att elektronen involverar kärnan i en slags moln som heter omlopps- (En omlopp är inte en bana) och elektronen, i en atomskala, är inte punktlig.
Om väteatomen breddas i stor utsträckning - till storleken på en fotbollsplan, skulle kärnan som består av en positiv proton vara storleken på en myra i mitten av fältet, medan den negativa elektronen skulle vara som ett slags spöke, spridd över fältet och omger den positiva kärnan.
Atommodellen idag
Denna "planetariska" atommodell är mycket förankrad och är den bild som de flesta har från atomen, eftersom den är mycket lätt att visualisera. dock, det är inte Modellen accepteras idag inom det vetenskapliga området.
Samtida atommodeller är baserade på kvantmekanik. Hon påpekar att elektronen i atomen inte är en liten punkt med negativ belastning som följer exakta banor, till exempel de som Rutherford föreställer.
Tvärtom, elektronen är spridd I områden, runt den positiva kärnan, kallad atomorbitaler. Från honom kan vi veta sannolikhet att träffas i ett eller annat tillstånd.
Trots detta innebar Rutherford -modellen ett enormt framsteg i kunskapen om atomens inre struktur. Och de attackerade vägen för fler forskare att fortsätta perfektionera det.
Referenser
- Andriessen, m. 2001. HSC -kurs. Fysik 2. Jacaranda HSc Science.
- Arfken, g. 1984. Universitetsfysik. Akademisk press.
- Riddare, r. 2017. Fysik för forskare och teknik: En strategistrategi. Pearson.
- Fysik OpenLab. Rutherford-Geiger-Marsden-experimentet. Återhämtat sig från: Physicsopenlab.org.
- Rex, a. 2011. Fysikens grunder. Pearson.
- Tyson, T. 2013. Rutherford -spridningsexperimentet. Återhämtat sig från: 122.Fysik.Ucdavis.Edu.
- Xaktly. Rutherfords experiment. Återhämtat sig från: xaktly.com.
- Wikipedia. Rutherford -experiment. Återhämtat sig från: det är.Wikipedia.org.
- « Autotrof näringsegenskaper, stadier, typer, exempel
- Anna Freud -biografi, teorier, försvarsmekanismer, fungerar »

