Kompressibilitetsfaktor Hur man beräknar, exempel och övningar
- 1559
- 156
- Lars Eriksson
han Kompressibilitetsfaktor z, o Komprimeringsfaktor för gaser, är ett dimensionslöst värde (utan enheter) som introduceras som en korrigering i den ideala gasens statusekvation. På detta sätt liknar den matematiska modellen det observerade beteendet hos gasen mer.
I den ideala gasen är tillståndsekvationen som hänför sig till variablerna P (tryck), V (volym) och T (temperatur): P.V idealisk = n.R.T med n = antal mol och r = konstant av de ideala gaserna. Tillsätt korrigeringen av Z -komprimeringsfaktorn förvandlas denna ekvation till:
P.V = z.n.R.T
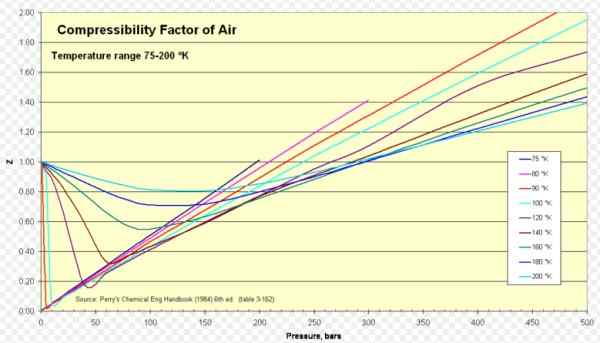
 Figur 1. Luftkompressibilitetsfaktor. Källa: Wikimedia Commons. https: // ladda upp.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png.
Figur 1. Luftkompressibilitetsfaktor. Källa: Wikimedia Commons. https: // ladda upp.Wikimedia.org/wikipedia/commons/8/84/compressibility_factor_of_air_75-200_k.Png. [TOC]
Hur man beräknar komprimeringsfaktor?
Med hänsyn till att molvolym är VHäftigt = V/n, Du har den verkliga molvolymen:
P . Vverklig = Z. R. T → Z = PV verklig/Rt
Eftersom Z -kompressibilitetsfaktorn beror på gasförhållanden uttrycks den som en funktion av tryck och temperatur:
Z = z (p, t)
Jämförelse av de två första ekvationerna noteras att om antalet mol n är lika med 1 är den molära volymen för en verklig gas relaterad till den för den ideala gasen genom:
Vverklig / Videalisk = Z → v verklig = Z Videalisk
När trycket överskrider de 3 atmosfärerna slutar de flesta av gaserna att uppträda som idealiska gaser och den verkliga volymen skiljer sig avsevärt från idealet.
Detta insåg i hans experiment den holländska fysikern Johannes van der Waals (1837-1923), vilket ledde till att han skapade en modell som bättre anpassades till de praktiska resultaten än ekvationen av idealiska gaser: statens ekvation av van der Waals.
Kan tjäna dig: natriumoxalat (Na2C2O4): struktur, egenskaper, användningar, riskerExempel
Enligt ekvationen P.Vverklig= Z.n.Rt, För en idealisk gas, z = 1. Men i riktiga gaser gör dock trycket genom att öka trycket. Detta är meningsfullt eftersom gasmolekyler vid större tryck har fler möjligheter att kollidera, därför ökar avvisningskrafterna och därmed volymen.
Å andra sidan till lägre tryck rör sig molekylerna med större frihet och avvisningskrafterna minskar. Därför förväntas en lägre volym. När det gäller temperaturen, när det ökar, minskar Z.
Som van der Waals observerade, i närheten av den så kallade kritiska punkten, avleds gasbeteende mycket från en idealisk gas.
Den kritiska punkten (Tc, Pc) av något ämne är tryck- och temperaturvärdena som bestämmer deras beteende innan en fasförändring:
-Tc Det är temperaturen över vilken gasen i fråga inte är flytande.
-Pc Det är det minsta trycket som krävs för att flytande gasen vid temperatur tc
Varje gas har sin egen kritiska punkt, men definierar temperaturen och minskat tryck tr Och sr som följer:
Pr = P / pc
Vr = V /vc
Tr = T /tc
Det observeras att en gas begränsad med identisk Vr och Tr utöva samma tryck Pr. Av denna anledning, om Z är grafiskt beroende på Pr till samma Tr, Varje punkt i den kurvan är densamma för alla gaser. Det här kallas Princip för motsvarande stater.
Kompressibilitetsfaktorn i idealiska gaser, luft, väte och vatten
Nedan är en kompressibilitetskurva för olika gaser vid olika reducerade temperaturer. Sedan några exempel på Z för vissa gaser och en procedur för att hitta Z genom att använda kurvan.
Kan tjäna dig: väte: historia, struktur, egenskaper och användningar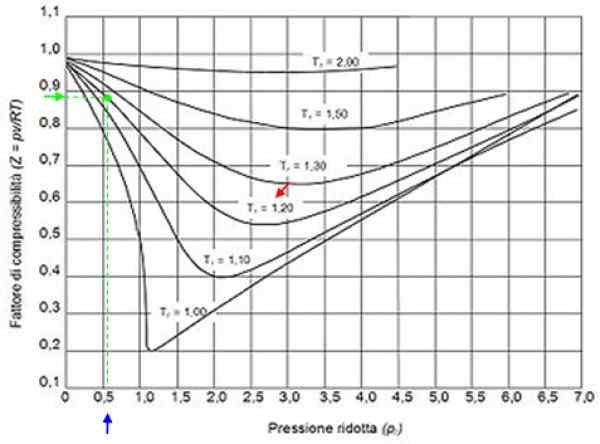 figur 2. Grafisk faktorgrafik för gaser enligt reduktionstryck. Källa: Wikimedia Commons.
figur 2. Grafisk faktorgrafik för gaser enligt reduktionstryck. Källa: Wikimedia Commons. Ideala gaser
De ideala gaserna har z = 1, som förklarats i början.
Luft
För Z Z är ungefär 1 i ett omfattande intervall av temperaturer och tryck (se figur 1), där den ideala gasmodellen ger mycket bra resultat.
Väte
Z> 1 för alla tryck.
Vatten
För att hitta z av vattnet behövs värdena på den kritiska punkten. Den kritiska punkten med vatten är: Pc = 22.09 MPA och Tc= 374.14 ° C (647.3 K). Återigen är det nödvändigt att ta hänsyn till att Z -kompressibilitetsfaktorn beror på temperaturen och trycket.
Anta till exempel att du vill hitta Z från vattnet vid 500 ºC och 12 MPa. Då är den första att beräkna den reducerade temperaturen, för vilken Celsius -graderna måste överföras till Kelvin: 50 ºC = 773 K:
Tr = 773/647.3 = 1.2
Pr = 12/22.09 = 0.54
Med dessa värden lokaliserar vi i grafen för figuren kurvan som motsvarar tr = 1.2, indikerad med en röd pil. Sedan tittar vi i den horisontella axeln värdet på Pr närmare 0.54, märkt i blått. Nu ritar vi en vertikal tills vi avlyssnar T -kurvanr = 1.2 Och slutligen projiceras det från den punkten till den vertikala axeln, där vi läser det ungefärliga värdet på z = 0.89.
Löst övningar
Övning 1
Det finns ett gasprov vid en temperatur av 350 K och ett tryck på 12 atmosfärer, med en molvolym 12 % högre än de förutsagda av den ideala gaslagen. Beräkna:
a) Z -kompressionsfaktor.
b) molvolym gas.
Kan tjäna dig: irreversibel reaktion: egenskaper och exempelc) Enligt ovanstående resultat, ange vilka som är de dominerande krafterna i detta gasprov.
Data: r = 0,082 l.atm/mol.K
Lösning till
Att veta att v verklig är 12 % högre än Videalisk :
Vverklig = 1.12videalisk
Z = v verklig / Videalisk = 1.12
Lösning B
P . Vverklig = Z. R. T → Vverklig = (1.12 x 0.082 x 350 /12) l /mol = 2.14 L/mol.
Lösning C
Avstötningskrafterna är de som dominerar, eftersom provets volym ökade.
Övning 2
Det finns 10 mol etan begränsade i en volym av 4.86 L A 27 ºC. Hitta det tryck som utövas av etan från:
a) Den ideala gasmodellen
b) Van der Waals -ekvationen
c) Hitta kompressionsfaktorn från föregående resultat.
Data för etan
Van der Waals koefficienter:
A = 5.489 DM6. Bankomat . mol-2 och b = 0.06380 DM3. mol-1.
Kritiskt tryck: 49 atm. Kritisk temperatur: 305 K
Lösning till
Temperaturen överförs till Kelvin: 27 º C = 27 +273 K = 300 K, kom också ihåg att 1 liter = 1 l = 1 dm3.
Därefter ersätts data som tillhandahålls i den ideala gasekvationen:
P.V = n.R.T → P = (10 x 0,082 x 300/4.86 L) ATM = 50.6 atm
Lösning B
Van der Waals statliga ekvation är:
Där A och B är koefficienterna som ges av uttalandet. När du rensar P:
Lösning C
Vi beräknar det reducerade trycket och temperaturen:
Pr = 35.2/49 = 0.72
Tr = 300 /305 = 0.98 ≈ 1
Med dessa värden söks värdet på Z i grafen i figur 2, och konstaterar att Z är ungefär 0.7.
Referenser
- Atkins, s. 1999. Fysisk kemi. Omega -utgåvor.
- Cengel och. 2012. Termodynamik. 7ma Utgåva. McGraw Hill.
- Engel, T. 2007. Introduktion till fysikaliski: termodynamik. Pearson.
- Levine, i. 2014. Principer för fysik-kemi. Sjätte. Utgåva. McGraw Hill.
- Wikipedia. Komprimeringsfaktor. Hämtad från: i.Wikipedia.org.

