Fenylalaninegenskaper, funktioner, biosyntes, mat
- 3150
- 669
- Johan Gustafsson
De Fenylalanin (Phe, F) är en av de nio essentiella aminosyrorna, det vill säga det är inte syntetiserat endogent av människokroppen. I sin sidokedja har denna aminosyran en icke -polär aromatisk förening som kännetecknar den.
Fenylalanin- eller p-fenyl-a-amino-propionsyra identifierades först 1879 av forskare J. H. Schulze och M. Barbieri från en växt från Fabaceae -familjen känd som Lupinus luteus eller "gul altramuz".
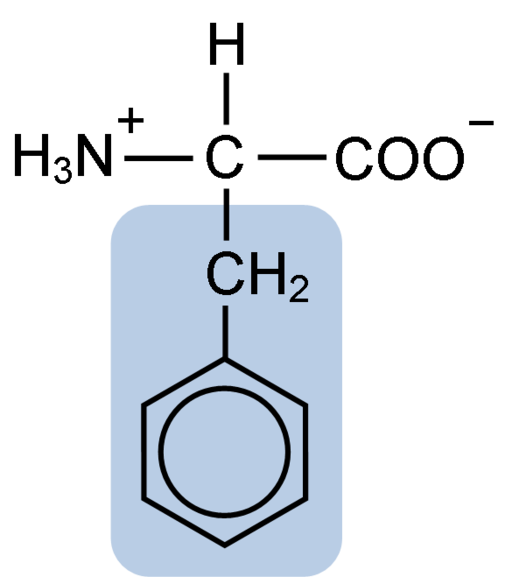
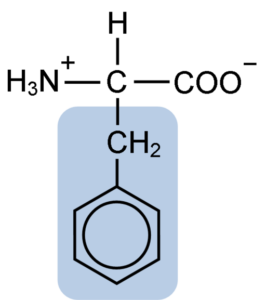 Kemisk struktur av aminosyran fenylalanin (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons)
Kemisk struktur av aminosyran fenylalanin (källa: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenser/BY-SA/4.0)] via Wikimedia Commons) Dipéptide L-Fenylalanin-L-Aspartil är känd som aspartam eller "nutrasweet", som är ett sötningsmedel som produceras syntetiskt och används allmänt på restauranger och kaféer, vanligtvis för att sötnera drycker som kaffe, te, limonad och andra drycker.
I frukt med uppvärmda egenskaper är omvandlingen av L-fenylalanin i fenolestrar såsom eugenol och dess metiliska derivat det som ger upphov till den söta blommig lukten eller liknar den typiska honung av bananer och bananer frukter när mogna mogna.
Beroende på form kan fenylalanin ha olika smaker. Till exempel har L-fenylalaninformen en söt arom och smak, medan D-fenylalanin är något bitter och vanligtvis tood.
Eftersom den har en stark hydrofob karaktär är fenylalanin en av de viktigaste beståndsdelarna i många av hartserna i naturen, såsom polystyren. Dessa hartser, när de kommer i kontakt med vattenmolekyler, bildar en skyddande eller täckningsstruktur som kallas "Clatrato".
Generna som kodar för biosyntesvägen för fenylalanin används av botaniker som evolutionära klockor, eftersom det har visat sig att dessa är relaterade till den morfologiska diversifieringen av markväxter.
[TOC]
Egenskaper och strukturera
Fenylalaninaktier med alla aminosyror karboxylgruppen (-COH), aminogruppen (-NH2) och väteatomen (-h) som är fästa vid en central kolatom känd som kol a. Dessutom har naturligtvis en sidokedja eller en karakteristisk R -grupp.
Fenylalanin är en av de tre aminosyrorna som har aromatiska eller bensenringar som substituenter i sidokedjor. Dessa föreningar är inte polära och är därför mycket hydrofoba.
Aminosyran i fråga är särskilt hydrofob, eftersom till skillnad från tyrosin och tryptofan (de andra två aminosyrorna med aromatiska ringar) inte har amino- eller hydroxylgrupper förenade till dess bensenring.
Den aromatiska, bensoiska eller sandylalaningruppen fenylalanin har den typiska bensenstrukturen: den cykliska ringen är strukturerad av 6 kolatomer som har resonans mellan dem på grund av närvaron av tre dubbelbindningar och tre enkla bindningar inuti inuti inuti.
Till skillnad från tyrosin och tryptofan, som kan få positiv och negativ belastning, behåller fenylalanin sin neutrala belastning, eftersom bensenringen inte är joniserad och massorna av karboxyl- och aminogrupper neutraliserar varandra.
Klassificering
Aminosyror klassificeras i olika grupper enligt de egenskaper som deras sidokedjor eller R -grupper har, eftersom de kan variera i storlek, struktur, funktionella grupper och till och med i elektrisk laddning.
Som nämnts klassificeras fenylalanin inom gruppen av aromatiska aminosyror, tillsammans med tyrosin och tryptofan. Alla dessa föreningar har aromatiska ringar i sin struktur, men tyrosin och tryptofan har joniserbara grupper i substituenterna i deras R -grupper.
Kan tjäna dig: Allopatric Speciation: Concept, Process and ExempelProteinljusabsorptionsegenskaperna vid en 280 nm våglängd beror på närvaron av aminosyrorna klassificerade i fenylalaningruppen, eftersom de lätt absorberar ultraviolett ljus genom sina aromatiska ringar.
Det har emellertid visats att fenylalanin absorberas i mycket mindre proportion än tyrosin och tryptofan, så i analysen av vissa proteiner är dess absorbans förutsägbar.
Stereokemi
Alla aminosyror har ett centralt quiralt kol, som har fyra förenade atomer eller grupper och som redan sagt identifieras denna atom som kol a. Baserat på detta kol kan minst två stereoisomerer av varje aminosyra hittas.
Stereoisomerer är molekyler med spekulära bilder, som har samma molekylformel, men som inte överlappar varandra såsom till exempel händer och fötter. De föreningar som experimentellt roterar det högra polariserade ljusplanet betecknas med bokstaven D, och de som gör det till vänster, med bokstaven L.
Det är viktigt att kommentera att skillnaden mellan D-fenylalanin- och L-fenylalaninformer är nyckeln till att förstå metabolismen hos denna aminosyra i ryggradsdjurens kropp.
L-fenylalaninformen metaboliseras och utnyttjas för konstruktion av cellproteiner, medan D-fenylalanin har hittats i blodomloppet som ett skyddande medel mot reaktiva syrearter (ROS).
Funktioner
På 90 -talet trodde man att fenylalanin bara var i vissa växtarter. Men idag är det känt att det finns i nästan alla hydrofoba proteiner av proteiner, i själva verket är fenylalanin huvudkomponenten i den aromatiska kemiska arter av proteiner.
I växter är fenylalanin en väsentlig komponent i alla proteiner; Dessutom är det en av föregångarna till sekundära metaboliter såsom fenylpropanoider (som är en del av pigmenten) av defensiva molekyler, flavonoider, biopolymerer som lignin och suberin, bland andra.
Fenylalanin är den grundläggande strukturen för att bilda många av molekylerna som upprätthåller neuronal homeostas, bland vilka är peptider såsom vasopressin, melanotropin och encefalin. Dessutom är denna aminosyra direkt involverad i syntesen av det adrenokortopiska hormonet (ACTH).
Liksom mycket av proteinaminosyror är fenylalanin en del av gruppen av ketogena och glukogena aminosyror, eftersom det tillhandahåller kolskelettet för mellanhänder i Krebs -cykeln, nödvändig för cell- och kroppsenergimetabolism.
När fenylalanin omvandlas till tyrosin och därefter till fumarat, en mellanhand av Krebs -cykeln.
Biosyntes
Fenylalanin är en av de få aminosyrorna som inte kan syntetiseras av de flesta ryggradsorganismer. För närvarande är endast biosyntetiska rutter kända för denna aminosyra i prokaryota organismer, i jäst, i växter och i vissa arter av svampar.
De gener som är ansvariga för syntesvägen är mycket bevarade mellan växter och mikroorganismer, därför har biosyntes liknande steg i nästan alla arter. Även vissa enzymer på rutten finns i vissa djur, men dessa kan inte syntetisera det.
Biosyntes av fenylalanin i växter
I växtarter syntetiseras fenylalanin genom en intern metabolisk väg i kloroplasterna som kallas "predetenatväg". Denna rutt är metaboliskt relaterad till "Shikimato-rutten", genom L-arogenato, en av metaboliterna som produceras under den senare.
Kan tjäna dig: topoisomeras: vad är, egenskaper, funktioner, typerInhydratasa Arewood -enzymet katalyserar en tre -steg -reaktion, där den förvandlar den aromatiska ringen av aromatet till den karakteristiska benseniska ringen av fenylalanin.
Detta enzym katalyserar en transamination, uttorkning och decarn.
Preeneaten bredvid det ackumulerade fenylpyruvatet inuti (ljuset) av kloroplasten kan omvandlas till fenylalanin genom reaktion katalyserad av enzymet aminotransferas propenato, som överför en aminogrupp till fenylpyruvatet så att det är erkänt av arenatasen och är integrerad och är integrerad och är integrerad till syntesen av fenylalanin.
I vissa arter av Pseudomonas Alternativa rutter har beskrivits för profenato, som använder olika enzymer men vars substrat för syntes av fenylalanin också är predetenatet och arenatet.
Degradering
Fenylalanin kan metaboliseras på flera sätt från mat. Den största mängden studier fokuserar emellertid på deras destination på centrala nervvävnadsceller och njurvävnader.
Levern är det huvudsakliga organet för nedbrytning eller katabolism av fenylalanin. I hepatocyter finns ett enzym som kallas hydroxylas fenylalanin, som kan transformera fenylalanin till tyrosin eller i föreningen L-3,4-dihydroxyfenylalanin (L-DOPA).
L-DOPA-föreningen är en föregångare till noradrenalin, epinefrin och andra hormoner och peptider med aktivitet i nervsystemet.
Fenylalanin kan oxideras i hjärnceller med hjälp av hydroxylas-tyrosin-enzymet, som är ansvarigt för att katalysera omvandlingen av fenylalanin till dopacrom i närvaro av L-askorbinsyra.
Tidigare trodde man att hydroxylas -tyrosinhydroxylas endast tyrosin, men det konstaterades att denna fenylalanin och tyrosinhydroxyle i samma andel och att hydroxylering av fenylalanin hämmar hydroxyleringen av tyrosinen.
För närvarande är det känt att höga proportioner av tyrosin hämmar den enzymatiska aktiviteten hos hydroxylas -tyrosin, men detsamma är inte sant för fenylalanin.
Livsmedel som är rika på fenylalanin
Alla protein -rika livsmedel har ett fenylalanininnehåll mellan 400 och 700 mg för den del av intaget mat. Mat som torskolja, färsk tonfisk, hummer, ostron och annan bivalve, innehåller mer än 1.000 mg per del av intaget mat.
Bovint och griskött har också höga nivåer av fenylalanin. De är emellertid inte så höga som koncentrationerna som finns i marina djur. Till exempel har bacon, nötkött, lever-, kyckling- och mejeriprodukter mellan 700 och 900 mg fenylalanin genom ration av mat.
Nötter som jordnötter och nötter av olika typer är andra livsmedel som har en bra mängd fenylalanin. Korn som sojabönor, kikärter och andra baljväxter kan ge mellan 500 och 700 mg fenylalanin efter del.
Som en alternativ källa kan fenylalanin metaboliseras från aspartam.
Fördelar med ditt intag
Fenylalanin finns i alla protein -rika livsmedel som vi konsumerar. Den lägsta dagliga konsumtionen för vuxna och medelstorlek är cirka 1000 mg, nödvändig för proteinsyntes, hormoner såsom dopamin, av olika neurotransmittorer, etc.
Det kan tjäna dig: vad är jordens naturliga mångfald?Konsumtionen av denna överskott av aminosyran föreskrivs för personer som har depressiva störningar, ledvärk och hudsjukdomar, eftersom dess konsumtion ökar syntesen av protein och överför biomolekyler såsom epinefrin, norepinefrin och dopamin.
Vissa studier tyder på att fenylalanin som konsumeras i överskott inte ger betydande förbättringar av någon av dessa störningar, men deras omvandling till tyrosin, som också används för syntes av signalmolekyler, kan förklara de positiva effekterna på cellsignalering i nervsystemet i nervsystemet nervsystem.
Läkemedel formulerade mot förstoppning har kärnor strukturerade av fenylalanin, tyrosin och tryptofan. Generellt sett innehåller dessa mediciner blandningar av dessa tre aminosyror i deras former L-y D-.
Brist
Blodfenylalaninnivåer är viktiga för att upprätthålla hjärnans korrekta funktion, eftersom fenylalanin, tyrosin och tryptofan är underlagen för montering av olika neurotransmittorer.
Vissa störningar hänför sig snarare med underskott i metabolismen i denna aminosyra, som genererar ett överskott av den istället för en brist.
Fenylcetonuria, en ovanlig ärftlig sjukdom hos kvinnor, påverkar leverhydroxylering av fenylalanin och gör plasmanivåerna för det aminosyran överdriven, så att en neuronal apoptos induceras och påverkar den normala utvecklingen av hjärnan.
Om en kvinna med fenylcetonuri blir gravid, kan fostret presentera det som kallas "hyperfenylalaninemia mödrar" fostersyndrom ".
Detta beror på att fostret har höga koncentrationer av fenylalanin i blodet (nästan dubbla standarderna), vars ursprung är relaterat till frånvaron av leverhydroxylasfenylalanin i fostret, som inte utvecklas förrän de 26 veckors graviditet.
Fostersyndrom av hyperfenylalaninemi mödrar, producerar fostermikrocefali, återkommande aborter, hjärtsjukdomar och till och med njurmissbildningar.
Referenser
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, e., Bottiglieri, l.,... & micu, r. (2018). Detektion och rensning av hydroxylradikal via D-fenylalaninhydroxylering i humana vätskor. Talanta, 181, 172-181
- Cho, m. H., Korea, o. R., Yang, h., Bedgar, D. L., Laskar, D. D., Anterola, a. M.,... & Kang, c. (2007). Fenylalaninbiosyntes i Thalian Arabidopsis Identifiering och karakterition av argenat dehydratas. Journal of Biologic Chemistry, 282 (42), 30827-30835.
- Fernström, J. D., & Fernström, m. H. (2007). Tyrosin, fenylalanin och katokolaminsyntes och funktion i hjärnan. Journal of Nutrition, 137 (6), 1539S-1547S.
- Hou, j., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., & Willner, jag. (2018). Katalyserad och elektrokatalyserad oxidation av L-tyrosin och L-fenylalanin till Dopachrome med nanozymer. Nano Letters, 18 (6), 4015-4022.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger principer för biokemi. Macmillan.
- Perkins, r., & Vaida, v. (2017). Fenylalanin ökar membranpermeabiliteten. Journal of the American Chemical Society, 139 (41), 14388-14391.
- PLIMMER, R. H. TILL. (1912). Proteins kemiska konstitution (Vol. 1). Longmans, grönt.
- Tensley, g. (2018). Hälsosjukdom. Hämtad 5 september 2018 från www.Hälsosjukdom.com/näring/fenylalanin
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie, till. R. (2013). Shikimate och fenylalaninbiosyntes i den gröna linjen. Frontiers in Plant Science, 4, 62.

