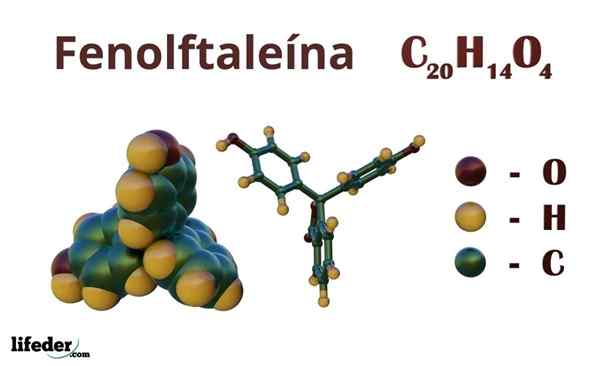
Fenolftalin (C20H14O4)
- 3537
- 194
- PhD. Emil Svensson
Vad är fenolftalin?
De fenolftalein Det är ett organiskt färgämne, som i sin tur är en svag diplinsyra, som används i många volymetriska bestämningar som en syrasindikator. Det vill säga, om det är en diplotsyra, i lösning kan du förlora två H -joner+, Och för att vara en indikator måste du ha egenskapen att vara färgglad i pH -intervallet som värderas.
I basmedium (pH> 8) är fenolftalin rosa, vilket kan intensifieras till en violett röd. För att användas som en syrasindikator bör du inte reagera snabbare med OH- av miljön som analyserar för att bestämma.
Eftersom det är en mycket svag syra utesluts dessutom närvaron av grupperna -COOH och därför är källan till syraprotoner två OH -grupper kopplade till två aromatiska ringar.
Formel
Fenolftalin är en organisk förening vars kondenserade kemiska formel är ctjugoH14ANTINGEN4. Även om du kanske inte är tillräckligt för att upptäcka vilka organiska grupper som har, från formeln kan du beräkna omättningen för att börja belysa ditt skelett.
Kemisk struktur
 Fenolftalein
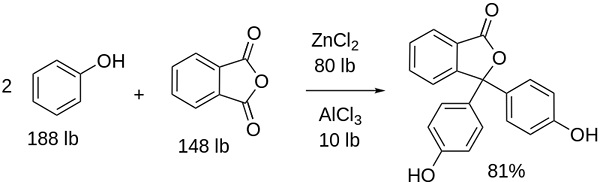
Fenolftalein Strukturen för fenolftalin är dynamisk, vilket innebär att det genomgår förändringar beroende på pH i omgivningen. I den överlägsna bilden illustreras strukturen för fenolftalein i intervallet 0 Det är den femkantiga ringen som lider av de största modifieringarna. Till exempel i basmedium, när en av OH-grupperna av fenolringar, deras negativa belastning (-O-) lockas till den aromatiska ringen, "öppnar" den femkantiga ringen i det nya arrangemanget av dess länkar. Här ligger den nya negativa belastningen i gruppen -coo-, som "kom ut" från den femkantiga ringen. Sedan, efter att ha ökat mediets basicitet, är den andra OH -gruppen av fenolringarna och den resulterande belastningen förödande i hela molekylstrukturen slukar. Den underordnade bilden sammanfattar resultatet av de två icke -deprotonering i grundläggande medium. Denna struktur är ansvarig för den bekanta rosa färgningen av fenolftalin. Elektronerna som "reser" genom det konjugerade π -systemet (representerat med de dubbla resonansbindningarna) absorberar i det synliga spektrumet, specifikt till våglängden för den gula färgen, vilket återspeglar den rosa färgen som når den förväntade ögat. Fenolftalin har totalt fyra strukturer. De två föregående är de viktigaste i praktiska termer och representeras förkortat som: h2I2-. Fenolftalin används i kemisk analys som en visuell indikator för att bestämma ekvivalenspunkten i neutraliseringsreaktioner eller syra-basgrader. Reagenset för dessa syrabasbedömningar framställs till 1 % upplöst i 90 % alkohol. Fenolftalin presenterar 4 stater: Detta beteende har gjort det möjligt att använda fenolftalin som en indikation på kolsyra av betong, som varierar pH till ett värde mellan 8,5 till 9. Förändringen i färg är också mycket plötslig; det vill säga anjonen i2- Rosa produceras med hög hastighet. Följaktligen tillåter detta dig att vara en kandidat som en indikator i många volymetriska bestämningar; Till exempel den för en svag syra (ättiksyra) eller stark (saltsyra). Fenolftalin användes som ett laxerande medel. Det finns emellertid en indikativ vetenskaplig litteratur som vissa laxermedel som innehåller fenolftalin som en aktiv princip - som verkar som hämmar absorptionen av vatten och elektrolyter i tjocktarmen som främjar evakueringar - kan ha negativa effekter. Den långvariga användningen av dessa mediciner som innehåller fenolftalin är förknippat med produktionen av flera störningar i tarmfunktion, pankreatit och till och med cancer, producerade främst hos kvinnor och hos djurmodeller som används för den farmakologiska studien av denna kemiska förening. Kemiskt modifierat fenolftalein och sedan omvandlar det till dess reducerade tillstånd, används som ett reagens i kriminaltekniska tester som möjliggör att bestämma närvaron av hemoglobin i ett prov (Kastle-Meyer-test), vilket inte är avgörande på grund av närvaron av falska positiver. Det bildas av kondensation av den ftaliska anhydriden med fenolen, i närvaro av koncentrerad svavelsyra och en blandning av aluminium och zinkklorider som katalysatorer av reaktionen: Aromatisk elektrofil substitution är mekanismen som styr denna reaktion. Vad består det av? Fenolringen (vänster molekyl) är negativt laddad tack vare syreatomen som är rik på elektroner, som kan göra något gratis par av dem att resa "den elektroniska kretsen" i ringen. Å andra sidan är kolet i grupp C = O för den ftaliska anhydriden. Den fenoliska ringen, rik på elektroner, attackerar detta dåliga kol i elektroner och innehåller den första ringen i strukturen. Denna attack sker företrädesvis i motsatt ände av kol kopplad till OH -gruppen; Detta är positionen -för. Detsamma gäller för den andra ringen: den attackerar samma kol och från detta släpps en genererad vattenmolekyl tack vare det sura mediet. På detta sätt är fenolftalin inget annat än en ftals anhydridmolekyl som har införlivat två fenolringar i en av dess Carbonillus -grupper (C = O). Dess fysiska utseende är det av ett vitt fast ämne med trikliniska kristaller, ofta agglomererade eller i form av rombiska nålar. Det är toalett, tätare än flytande vatten (1 277 g/ml vid 32 ºC) och mycket lite flyktig (uppskattat ångtryck: 6,7 x 10-13 mmhg). Det är väldigt lite lösligt i vatten (400 mg/L), men mycket lösligt i alkoholer och eter. Av denna anledning rekommenderas det att utspäda det i etanol innan det används. Det är olösligt i aromatiska lösningsmedel såsom bensen och toluen, eller i alifatiska kolväten såsom n-hexan. Finns vid 262,5 ºC och vätskan har en kokpunkt på 557,8 ± 50,0 ºC till atmosfärstryck. Dessa värden indikerar starka intermolekylära interaktioner. Detta beror på vätebroar, liksom de främre interaktionerna mellan ringarna. Dess PKA är 9,7 till 25 ºC. Detta innebär en mycket låg trend att dissociera i vattenhaltigt medium: H2I (ac) + 2h2Eller (L) i2-(AC) + 2H3ANTINGEN+ Detta är en vattenhaltig balans. Emellertid ökningen av OH -joner- I lösningen minskar den nuvarande mängden H3ANTINGEN+. Följaktligen rör sig balansen till höger för att producera mer h3ANTINGEN+. På detta sätt belönas dess initiala förlust. När mer bas läggs till fortsätter balansen att röra sig till höger, och så vidare tills det inte finns något av arten h2I. Vid denna tidpunkt är arten i2- Rosado färg lösningen. Slutligen sönderdelas fenolftalin vid uppvärmning, avger en tunnland och irriterande rök.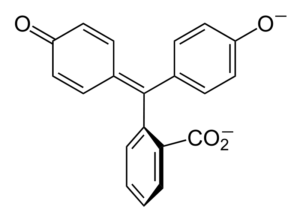
Användningar/tillämpningar av fenolftalin
 Lägga till alkalisk lösning till neutral lösning med fenolftaleinindikator
Lägga till alkalisk lösning till neutral lösning med fenolftaleinindikator Indikatorfunktion
Användningar inom medicin
Fenolftaleinsyntes
Fenolftaleinegenskaper
Referenser