Natriumfosfatstruktur, egenskaper, syntes, användningar

- 4127
- 464
- Prof. Erik Johansson
han Natriumfosfat Det är ett oorganiskt salt vars kemiska formel är na3Po4. Den får också trisodiga fosfatnamn (TSP för sin förkortning på engelska: Trisodiumfosfat) eller tribasiskt natriumfosfat, eftersom det helt saknar förmågan att donera vätejoner h+.
När man hänvisar till det på ett flertal sätt, natriumfosfater, är det prat om hela kompendiet av salter, hydratiserade eller inte, härstammar från elektrostatiska interaktioner mellan NA+ och po43-. Några av dessa salter består till och med av natriumpyrofosfater, eller oorganiska polymerer som har PO43- Som monomer.
 Klockglas med natriumfosfatkristaller. Källa: Ondřej Mangl [Public Domain]
Klockglas med natriumfosfatkristaller. Källa: Ondřej Mangl [Public Domain] Det är därför, såvida inte en specifikation görs, kommer den alltid att hänvisa till NA3Po4, Och inte till nah2PO4, NA2Hpo4, Na4P2ANTINGEN7 Inte annat salt.
Den övre bilden visar utseendet på natriumfosfat, som ser vita kristaller som liknar de för vanligt salt eller bord, eller köpt som ett vitt amorft utseendepulver. Då en3Po4 kan bilda flera hydrater, vara NA3Po4· 12 timmar2Eller den som är mest marknadsförd.
Den finner användning huvudsakligen inom livsmedelsindustrin, i tvättmedel, sporttillskott och fungerar som hyperosmotiskt laxermedel.
[TOC]
Kemisk struktur
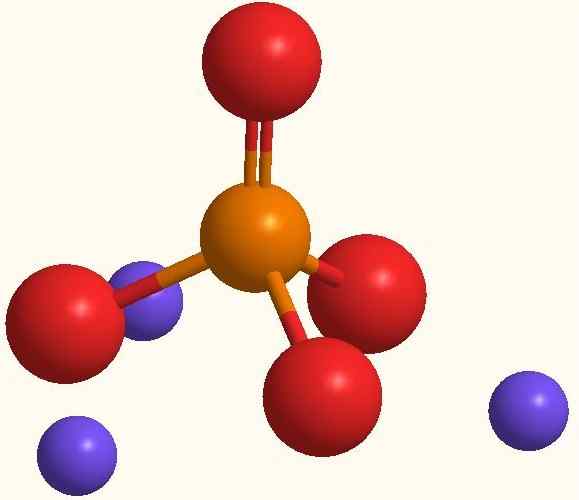 Huvudjoner av natriumfosfat. Källa: Smolamj via Wikipedia.
Huvudjoner av natriumfosfat. Källa: Smolamj via Wikipedia. Samma NA -formel3Po4 indikerar att för varje anjon PO43- Det finns tre NA -katjoner+. Dessa joner kan observeras i den överlägsna bilden. Observera att PO43- Den har tetraedral geometri, med sina syreatomer som bär en resonans negativ belastning, som lockar NA+ av miljön.
Också NA -formeln3Po4 Han påpekar att det är vattenfritt salt, så det finns inga vattenmolekyler som ingår i deras kristaller. Elektrostatiska attraktioner mellan NA+ och po43- De definierar en trigonal vit kristall. Dess joniska länk är sådan att NA3Po4 Den har en fusionspunkt på 1583 ºC, betydligt högre än för flera salter.
Kan tjäna dig: Cannizzaro -reaktion: egenskaper, mekanismer, exempelBåda NA+ Som PO43- De är joner som kan hydratiseras i hög grad utan att påverka kristallernas stabilitet negativt.
Det är av denna anledning som hydrater också kan kristallisera; Emellertid är dess smältpunkter lägre än för vattenfritt salt, eftersom intermolekylära vätebroar i vattnet separerar jonerna och försvagar deras interaktioner. I NA3Po4· 12 timmar2Eller till exempel är dess smältpunkt 73,4 ºC, mycket mindre än för NA3Po4.
Egenskaper
Fysiskt utseende
Det kan uppstå som definierade vita kristaller eller som ett damm eller granuler av samma färg. Alla fysiska storlekar som uttrycks under hänvisar endast till det naiva saltet3Po4.
Smältpunkt
1583 ºC
Kokpunkt
100 ºC
Vattenlöslighet
14,5 g/100 ml vid 25 ° C, så det anses vara ett ganska lösligt vattenfosfat. Det är emellertid olösligt i organiska lösningsmedel såsom etanol och koldisulfid.
Densitet
2,536 g/cm3 vid 17,5 ºC.
Stabilitet
Det är ett hygroskopiskt fast ämne. Därför måste det förvaras på ett sådant sätt att det inte kan utsättas för fukt.
pH
Det är ett starkt alkaliskt salt. Till exempel har en vattenlösning av den 0,1% redan pH 11,5. Den här egenskapen tjänar att användas som tillsatsmedel i tvättmedel.
Syntes
Hur produceras eller syntetiseras natriumfosfat? För att göra detta är det baserat på fosforsyra, h3Po4, eller från saltfosfat salt natrium, nah2Po4.
I den stora majoriteten av syntesen föredras H3Po4. Således reageras H3Po4 Med en bas som neutraliserar sina tre OH -grupper, med hänsyn till att denna syra också kan skrivas som PO (OH)3.
Kan tjäna dig: Ämnesbalans: Vad är, allmän ekvation, typerBasen efter preferens är natriumhydroxid, NaOH (i Tyskland), men det är också livskraftigt (och billigare) att använda natriumkarbonat eller SOSA: s aska, NA2Co3 (i USA). Ekvationerna för båda neutraliseringsreaktionerna är:
Na2Co3 + H3Po4 → Na2Hpo4 + Co2 + H2ANTINGEN
Na2Hpo4 + NaOH → Na3Po4 + H2ANTINGEN
Observera att när du använder NA2Co3 NA erhålls inte3Po4 Men NA2Hpo4, som kommer att behöva efterföljande neutralisering. Att vara den vattenhaltiga reaktionen betyder, kristalliserar NA3Po4· 12 timmar2Eller så måste det beräknas för att eliminera dess vatteninnehåll och orsaka vattenfritt salt.
Då en3Po4· 12 timmar2O Det kännetecknas av att "slå samman" deras kristaller i en svår kompakt massa. Ju mindre storlek på deras kristaller, desto snabbare är kalcinering.
Ansökningar
Mat
 Natriumfosfat används som ett brusande medel för att utöka kanelroller eller kakor. Källa: Pixabay.
Natriumfosfat används som ett brusande medel för att utöka kanelroller eller kakor. Källa: Pixabay. I natriumfosfat använder det oundvikligt att blanda NA3Po4 eller na3Po4· 12 timmar2Eller eftersom det senare är det hydrat som är mest marknadsfört. Till exempel ger någon av de två ofarliga (i teorin) joner till maten som de tillsätts, berikar dem för fosfater och samtidigt ökar deras salthalt.
I köttens salar, NA3Po4· 12 timmar2Eller ingår för att hålla dem fräscha längre under deras lagring. Det läggs också till som ett emulgeringsmedel så att oljevattenblandningen inte är "skär" utan förblir förenad; Och som pH -regulator, eftersom det hjälper till att minska livsmedelens surhet (inklusive spannmål).
Kan tjäna dig: kalciumsilikat: egenskaper, struktur, erhållning, användningDessutom används det för att tjockna vissa tomatsåsar och för kakor eller brödbakning (överlägsen bild). Det senare beror på att NA3Po4· 12 timmar2Eller tenderar att frigöra vattenånga, vilket ökar storleken på mjölmassans porer och volymen på samma.
Tvättmedel
Natriumfosfat är tillräckligt grundläggande för att förtva upp vissa fetter eller oljor som du har kontakt. Dess alkalinitet används sedan för att förbättra verkan av tvättmedel, så länge ytan till elände inte är metall, eftersom de kan försämras den.
Produktionen av tvättmedel berikade med fosfater har emellertid reducerats eftersom de producerar eutrofering av sjöar och floder och med den spridningen av alger som täcker deras ytor.
Det har också använts för utarbetande av ett desinfektionsmedel: NA3Po4· 1/4naocl · 11h2Eller, som framställs med natriumhypoklorit, NaOCL, istället för NaOH eller Na2Co3 Att neutralisera h3Po4.
Medicinsk
Då en3Po4 Det inducerar avföring genom att fungera som ett hyperosmotiskt laxermedel, nödvändigt för att rengöra kolon innan patienten genomgår en koloskopi. Å andra sidan har den också använts (tillagd) i energitillskott.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Nationellt centrum för bioteknikinformation. (2019). Trisodiumfosfat. Pubchemdatabas. CID = 24243. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Wikipedia. (2019). Trisodiumfosfat. Hämtad från: i.Wikipedia.org
- Curran m.P. & Plosker G.L. (2004). Oral natriumfosfatlösning: En översyn av dess användningar till kolorektal rengöringsmedel. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22 december 2017). Natriumfosfat. Återhämtat sig från: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Process för produktion av trisodiumfosfat. Hämtad från: Freepatentssonline.com
- MaryAnn Marks. (2018). Varför läggs trisodiumfosfat (TSP) till vår mat? Återhämtat sig från: TheingredientGuru.com

