Kondenserad formel Vad är och exempel (metan, etan, glukos ...)
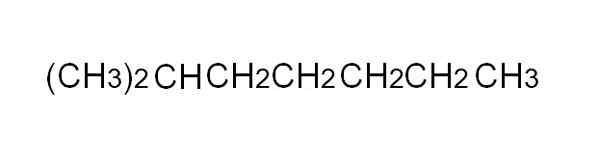
- 1608
- 45
- Prof. Erik Johansson
De kondenserad formel Det är en rent textlig representation av en molekyl där länkarna utelämnas. Syftet är att veta vad som är beställningen av atomer. Generellt sett linjära eller grenade molekyler har kondenserade formler, utom cykliska eller de som är mycket grenade.
I organisk kemi finns det vanligtvis förvirring av vad som är skillnaden mellan denna formel och molekyl. Det är faktiskt vanligt att hitta dem som synonymer. Under tiden används de molekylära formlerna i oorganisk kemi mer, eftersom de kovalenta föreningarna i de flesta fall med rätta beskriver; Som vatten, h2ANTINGEN.
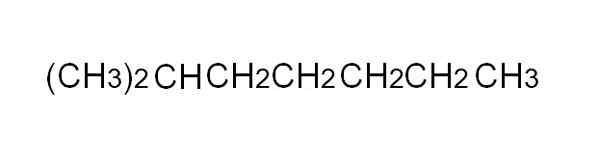 Kondenserad formel av 2-metylheptano. Källa: Gabriel Bolívar.
Kondenserad formel av 2-metylheptano. Källa: Gabriel Bolívar. [TOC]
Vad är den kondenserade formeln?
För att definiera det mer bekvämt är den kondenserade formeln en förenklad representation av den halvutvecklade. Det är inte nödvändigt att skriva de enkla länkarna, och det bör inte heller täcka mer än en rad i en text. Till exempel kan 2-metylheptano, en grenad alkan, representeras i samma linje som i den övre bilden.
Kondenserade formler är användbara för att representera vissa molekyler utan att behöva rita dem. Detta är utmärkt när kemiska ekvationer skrivs där cykliska eller mycket grenade molekyler inte deltar. Det kommer att ses att dessa formler tar till parentes för att ytterligare förenkla representationen av en molekyl.
Exempel
Metan
Metan är den enda kemiska föreningen som har en enda formel: Ch4. Detta motsvarar den empiriska, molekylära, kondenserade och halvutvecklade samtidigt. Det är därför som många gånger, för att rädda en förvirring mellan alla dessa koncept, föredrar människor att hänvisa enkla och oprekligt till en förenings "kemiska formel".
Etano
Estano har en molekylär formel c2H6. Den kondenserade formeln är istället Cho3Ch3. Observera att C-C-länken och C-H-länkarna utelämnas. Tanken är att kunna skriva formeln som om det var ett "ord", utan att behöva rita ränder eller rita strukturer.
Kan tjäna dig: pycnometerPer definition är molekylformeln c2H6 och inte ch3Ch3; Men för enkla molekyler är båda formlerna vanligt att byta ut, även om det fortfarande är felaktigt. Detta är en skillnadspunkt mellan flera källor, där det uppenbarligen finns specifika regler i detta avseende.
Glukos och fruktos
Här är ett exempel där ett fel omedelbart observeras när du vill byta ut molekylformeln för kondensatet.
Det söta, glukos- och fruktosmomentet har samma molekylformel: c6H12ANTINGEN6, Och därför tjänar detta inte till att differentiera dem. Däremot upprättar strukturella och halvutvecklade formler olika molekyler i sikte.
Glukos eller fruktos har emellertid en kondenserad formel. Detta beror på att oavsett deras representation eller projektion kan deras strukturer inte skrivas i samma linje; eller åtminstone på ett sätt som är trevligt och enkelt i läsarens ögon.
Butan
Butano har en molekylär formel c4H10. Den har två isomerer: de linjära, n-Butano och grenad, 2-metylpropan. Båda kan representeras av sina kondenserade formler. han n-Butano är ch3Ch2Ch2Ch3 eller ch3(Ch2)2Ch3, Och 2-metylpropan är Cho3Ch (ch3)2 eller (ch3)3Ch.
I 2-metylpropan har vi en grupp ch omgiven av tre Cho3. Dess två formler är giltiga och parentes används för att lyfta fram konsekvenserna, prenumerationen är en indikator på hur många grupper som utgör denna gren.
Etanol
Etanol har en kondenserad formel ch3Ch2Åh. Observera hur mycket det liknar sin halvutvecklade formel: ch3-Ch2-Åh. På samma sätt görs det med propanol, cho3Ch2Ch2Åh, n-Butanol, ch3Ch2Ch2Ch2Åh, och med alla andra alkoholer.
Kan tjäna dig: natriumfosfat: struktur, egenskaper, syntes, användningOm de har en gren kommer det att anges inom en parentes till höger om atomen som den är kopplad. Till exempel kan 2-metylbutanolen skrivas som: ch3Ch2Ch (ch3) Ch2Åh. Observera att det för många molekyler börjar vara mer bekvämt att ta till en strukturell eller halvutvecklad formel.
Pentano
Pentans linjära isomer, n-Pentano, det är lätt att representera för sin kondenserade formel: Cho3Ch2Ch2Ch2Ch3. Denna formel kan också förenklas med parentes: ch3(Ch2)3Ch3, indikerar att mellan de två ch3 Det finns tre ch2.
De andra två isomererna i Pentan är emellertid lite mer komplicerade: ch3Ch2Ch (ch3)2, För 2-metylbutan och C (CH3)4 För 2,2-dimetylpropan eller neopantum. Observera att kolatomen till vänster om parentesen är den som bildar länkar till substituenter eller förgreningar.
Oktan
Oktanens linjära isomer, n-Octan, på grund av sin längd, är det nu lämpligt att representera sin kondenserade formel som Cho3(Ch2)6Ch3. Det är vid denna tidpunkt där något som är klart från kondenserade formler bör vara: de försöker spara tid när de representerar molekyler eller föreningar, utan att skriva så mycket på papper.
Cyklohexan
Fallet med cyklohexan liknar det för glukos och fruktos: saknar formellt en kondenserad formel för att vara en cyklisk förening. Ett sätt att försöka representera det skulle vara: (Ch2)6, vilket innebär att sex grupper väljer2 De måste vara länkade och är möjliga endast om de stänger i en hexagonal ring. Det är dock bättre att dra ringen.
Aceton
Aceton presenterar det speciella att ha en karbonylgrupp, C = O. För att skriva din kondenserade formel har vi därför tre alternativ: (Ch3)2CO, ch3C (o) ch3 eller ch3(C = o) ch3.
Kan tjäna dig: kaffesyra: struktur, egenskaper, biosyntes, användningarI större molekyler representeras faktiskt karbonylgruppen som (O), med hänsyn till att kolatomen till vänster är den som bildar dubbelbindningen med syre, C = O.
Ättiksyra
Den kondenserade formeln för ättiksyra är Cho3Cooh o ch3Co2H. Här är en viktig punkt: de funktionella grupperna skrivna i samma linje är delar av en kondenserad formel. Detta var fallet med etanol och aceton, och gäller också tioles (-sh), aldehydos (-cho) estrarna (-co2R o -coor) och aminer (-NH2).
Generell kommentar
Det finns många förvirring mellan molekylära och kondenserade formler. Kanske beror det på att dessa representationer ensam redan ger en ungefärlig bild av molekylen, så vi tror att det är molekylformeln.
Även formler som C6H12ANTINGEN6 De betraktas också som kondensat, eftersom de förenklas, "kondenserar" molekylen i atomer och abonnemang. Det är därför det är vanligt att se hur de två formlerna nämns som om de var synonymer.
I många källor, inklusive Wikipedia -artiklar, används termerna "kemisk formel" för att hänvisa till molekylär (typ C6H12ANTINGEN6 och andra) och 'formel' för att hänvisa till kondensatet.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (18 november 2019). Kondenserad formeldefinition i kemi. Återhämtat sig från: tankco.com
- James Ashenhurst. (11 december 2019). Kondenserade formler: dechiffrera vad ryggen betyder. Master Organic Chemistry. Återhämtat från: Masterorganicchemistry.com
- Copolingenieria. (2 maj 2016). Empirisk, strukturell och kondensatformel. Hämtad från: Chemiotecablog.WordPress.com
- Introduktion till kemi: Allmänt, organiskt och biologiskt. (s.F.). Kondenserade strukturella och linvinkelformler. Återhämtat från: 2012 -böcker.Späck.org

