Heptano (C7H16) struktur, egenskaper och användningar
- 1492
- 346
- PhD. Emil Svensson
han heptano Det är en organisk förening vars kemiska formel är c7H16 och består av nio strukturella isomerer, av vilka det mest kända är det linjära. Det är ett kolväte, speciellt en alkan eller paraffin, som finns i de flesta organiska kemilaboratorier, vare sig undervisning eller forskning.
Till skillnad från andra paraffiniska lösningsmedel har heptano en lägre volatilitet, vilket gör dess relativt säkrare användning; Närhelst det inte finns någon värmekälla som omger dina ångor och det fungerar i en extraktorklocka. Om han lämnar sin brandfarlighet åt sidan är det en tillräckligt inert förening för att tjäna som ett medel för organiska reaktioner.
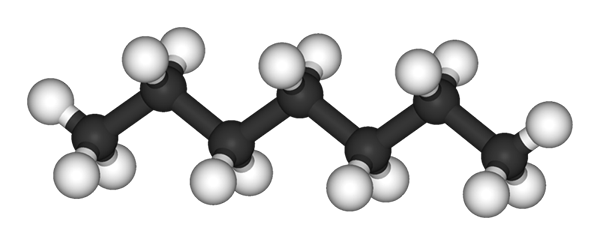
 N-heptanomolekyl representerad av en modell av sfärer och staplar. Källa: Ben Mills och Jynto [Public Domain]
N-heptanomolekyl representerad av en modell av sfärer och staplar. Källa: Ben Mills och Jynto [Public Domain] I den övre bilden har du strukturen på n-heptano, den linjära isomeren från alla heptaner. Eftersom det är den vanligaste isomeren och större kommersiellt värde, såväl som det enklaste att syntetisera, tenderar det att vara i slutet att termen "heptano" uteslutande hänvisar till n-heptano; om inget annat anges.
Men i flaskorna i denna flytande förening anges det att den innehåller n-heptano. De måste avslöja inuti en extraktklocka och utföra mätningarna noggrant.
Det är ett utmärkt lösningsmedel för fetter och oljor, så det används ofta under växtessenser eller andra naturliga produkter.
[TOC]
Strukturera
n-heptan och dess intermolekylära interaktioner
Som framgår av den första bilden, molekylen för n-Heptano är linjär, och på grund av den kemiska hybridiseringen av dess kolatomer antar kedjan en sickzagueada -form. Denna molekyl är dynamisk, eftersom dess C-C-bindningar kan rotera, vilket gör att kedjan viker något i olika vinklar. Detta bidrar till dess intermolekylära interaktioner.
Det kan tjäna dig: pi -länkhan n-Heptano är en apolär, hydrofob molekyl, och därför är dess interaktioner baserade på de spridande krafterna i London; Dessa är de som är beroende av föreningens molekylmassa och dess kontaktområde. Två molekyler av n-heptan.
Dessa interaktioner är tillräckligt effektiva för att upprätthålla molekylerna för n-Heptano sammanhängande i en vätska som kokar vid 98 ºC.
Isomerer
 Heptans nio isomerer. Källa: Steffen 962 [Public Domain]
Heptans nio isomerer. Källa: Steffen 962 [Public Domain] Först sades det att formel C7H16 representerade totalt nio strukturella isomerer, var n-Heptan den mest relevanta (1). De andra åtta isomererna visas i den övre bilden. Notera med blotta ögat att vissa är mer grenade än andra. Från vänster till höger, från ovan, har vi:
(2): 2-metylhexan
(3): 3-metylhexan, som består av ett par enantiomerer (A och B)
(4): 2,2-dimetylpentano, även känd som neoheptano
(5): 2,3-dimetylpentano, igen med ett par enantiomerer
(6): 2,4-dimetylpentano
(7): 3.3-dimetylpentano
(8): 3-etylpentan
(9): 2,2,3-trimetylbutan.
Var och en av dessa isomerer har oberoende egenskaper och tillämpningar av n-Heptano, reserverade mer än någonting för organiska syntesområden.
Hepthane -egenskaper
Fysiskt utseende
Färglös vätska med en lukt som liknar bensin.
Molmassa
100 205 g/mol
Smältpunkt
-90,549 ºC, blir en molekylär kristall.
Kokpunkt
98,38 ºC.
Ångtryck
52,60 atm vid 20 ºC. Observera hur högt ditt ångtryck är, trots att det är mindre flyktigt än andra paraffiniska lösningsmedel, såsom Hexano och Pentan.
Densitet
0,6795 g/cm3. Å andra sidan är Heptano -ångor 3,45 gånger täta än luft, vilket innebär att deras ångor kommer att hålla i utrymmen där ett litet utsläpp av deras vätska.
Kan tjäna dig: myrsyra (HCOOH)Vattenlöslighet
Heptanen för att vara en hydrofob förening kan knappt lösa upp i vattnet för att orsaka en lösning med en koncentration av 0,0003% vid en temperatur av 20 ºC.
Löslighet i andra lösningsmedel
Hepthane är blandbar med koltetraklorid, etanol, aceton, oljeeter och kloroform.
Brytningsindex (nD)
1 3855.
Gegga
0,389 MPa · s
Värmekapacitet
224.64 J/K · mol
antändningspunkt
-4 ºC
Självriktningstemperatur
223 ºC
Ytspänning
19,66 mn/m a 25 ºC
Förbränningsvärme
4817 kJ/mol.
Reaktivitet
Hepthane -ångor när de är nära en värmekälla (en låga), reagerar exotermiskt och kraftfullt med luftens syre:
C7H16 + 11o2 => 7co2 + 8h2ANTINGEN
Men utanför förbränningsreaktionen är heptan en ganska stabil vätska. Dess brist på reaktivitet beror på att deras C-H-länkar är svåra att bryta, så det är inte mottagligt för ersättningar. Det är inte heller särskilt känsligt för starka oxidationsmedel, förutsatt att det inte finns någon eld i närheten.
Den största faran med Heptano representeras av dess höga volatilitet och brandfarlighet, så det finns en brandrisk om den spillas på heta platser.
Ansökningar
Lösningsmedel och en halv reaktion
 Hepthane är ett utmärkt lösningsmedel för att lösa upp oljor och fetter. Källa: Pxhere.
Hepthane är ett utmärkt lösningsmedel för att lösa upp oljor och fetter. Källa: Pxhere. Heptanos hydrofoba karaktär är ett utmärkt lösningsmedel för att lösa oljor och fetter. I denna aspekt har det använts som en avfettningsmedel. Emellertid ligger dess största applicering i att användas som ett extraktorlösningsmedel, eftersom det löser upp lipidkomponenterna, liksom de andra organiska föreningarna i ett prov.
Om du till exempel vill extrahera alla komponenter i malt kaffe, skulle det masereras i heptan istället för vatten. Denna metod och dess variationer har implementerats med alla typer av frön, tack vare vilka växtessenser och andra naturliga produkter har erhållits.
Det kan tjäna dig: enhetscell: egenskaper, röda konstanter och typerHeptanen, som är naturligt färglös, kommer att färgas från färgen på den extraherade oljan. Sedan roteras detta för att äntligen ha en volym av oljan så ren som möjligt.
Å andra sidan tillåter den lilla reaktiviteten hos heptanen också att vara ett alternativ när du överväger ett reaktionsmedel för att utföra en syntes. Som ett bra lösningsmedel av organiska föreningar garanterar det att reagensen förblir i lösning och interagerar med varandra när de reagerar.
Fällande medel
I oljekemi är det vanligt att fälla ut asfaltens av ett rå prov genom att lägga till heptano. Denna metod gör det möjligt att studera stabiliteten hos olika råa och bestämma hur mottaglig dess asfalteninnehåll är att fälla ut och bära en hel serie problem för oljeindustrin.
Oktan
Heptanen har använts som bränsle på grund av den stora mängden värme den erbjuder när den brinner. Men när det gäller bilmotorer skulle det vara skadligt för dess drift om den skulle användas rent. Eftersom det brinner mycket explosivt tjänar det till att definiera 0 på oktanskalan av bensin.
Bensin innehåller en hög andel av heptano och andra kolväten för att jämna oktan till kända värden (91, 95, 87, 89, etc.).
Referenser
- Morrison, r. T. och Boyd, R, N. (1987). Organisk kemi. Femte upplagan. Redaktör Addison-Wesley Inter-American.
- Carey f. (2008). Organisk kemi. (Sjätte upplagan). MC Graw Hill.
- Graham solomons t.W., Craig b. Fryhle. (2011). Organisk kemi. (10: e upplagan.). Wiley Plus.
- Wikipedia. (2020). Heptan. Hämtad från: i.Wikipedia.org
- Nationellt centrum för bioteknikinformation. (2020). Heptan pubchem -databas. CID = 8900. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Elsevier b.V. (2020). Heptiker. Vetenskaplig. Hämtad från: Scientedirect.com
- Bell Chem Corp. (7 september 2018). Industriell användning av heptan. Återhämtat sig från: bellchem.com
- Andrea Kropp. (2020). Heptan: Struktur, användning och formel. Studie. Återhämtat sig från: studie.com
- « Kondenserad formel Vad är och exempel (metan, etan, glukos ...)
- Mekaniska energiformler, koncept, typer, exempel, övningar »

