Halvutvecklad formel Vad är och exempel (metan, propan, butan ...)
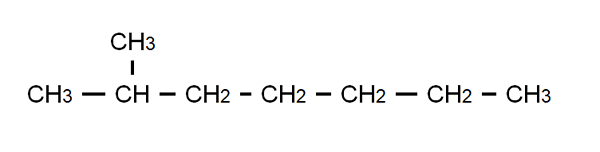
- 3872
- 306
- Anders Svensson
De Halvutvecklad formel, Även känd som den semi -strukturella formeln är det en av de många möjliga representationer som kan ges till molekylen i en förening. Det är mycket återkommande i organisk kemi, särskilt i akademiska texter, eftersom med det korrekt beställning av en molekyl och dess kovalenta bindningar visas.
Till skillnad från den utvecklade formeln, som blir densamma som den strukturella formeln, visar den inte C-H-bindningarna och utelämnar dem för att förenkla representationen. Från denna formel kommer alla läsare att kunna förstå vad skelettet för en molekyl är; Men inte dess geometri eller någon av de stereokemiska aspekterna.
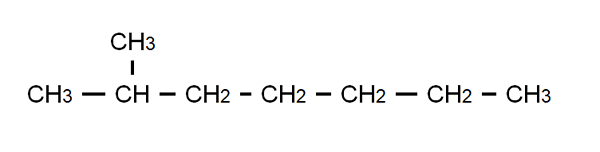 Halvutvecklad formel för 2-metylheptano. Källa: Gabriel Bolívar.
Halvutvecklad formel för 2-metylheptano. Källa: Gabriel Bolívar. För att klargöra denna punkt har vi den halvutvecklade formeln för 2-metylheptano: en grenad alkan vars molekylformel är C är8H18, och det följer den allmänna formeln cnH2n+2. Observera att molekylformeln säger absolut ingenting om strukturen, medan den halvutvecklade den gör det möjligt att visualisera vad denna struktur är.
Observera på samma sätt att C-H-bindningar utelämnas, vilket endast markerar C-C-bindningarna som utgör den kolsyrade kedjan eller skelettet. Det kommer att ses att för enkla molekyler sammanfaller den utvecklade formeln med den kondenserade formeln; Och till och med med molekylär.
[TOC]
Exempel
Metan
Molekylformeln för metan är Cho4, Det har fyra C-H-länkar och är tetraedral geometri. Dessa data tillhandahålls av den strukturella formeln med kilar utanför eller under planet. För metan blir den kondenserade formeln också Cho4, Som empirisk och halvutvecklad. Detta är den enda föreningen som nämnda singularitet är uppfyllda.
Anledningen till att den halvutvecklade formeln för metan är Cho4, Det beror på att deras C-H-länkar inte är skrivna; För att göra det skulle det motsvara den strukturella formeln.
Kan tjäna dig: solvationPropan
Den halvutvecklade formeln för propan är Cho3-Ch2-Ch3, har bara två C-C-länkar. Dess molekyl är linjär, och om den visar är dess kondenserade formel exakt densamma: Cho3Ch2Ch3, Med den enda skillnaden att C-C-länkar utelämnas. För propan uppfylls att både den halvutvecklade och kondenserade formeln sammanfaller.
I själva verket uppfylls detta för alla alkaner av linjära kedjor eftersom det kommer att fortsätta att ses i följande avsnitt.
Butan
Den halvutvecklade butanformeln är Cho3-Ch2-Ch2-Ch3. Observera att det kan skrivas i samma rad. Denna formel motsvarar strikt den n-butan, vilket indikerar att det är den linjära och obehagliga isomeren. Den grenade isomeren, 2-metylpropan, kommer att ha följande semi-utvecklade formel:
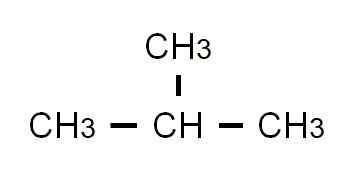 Semi-utvecklad formel av 2-metylpropan. Källa: Gabriel Bolívar.
Semi-utvecklad formel av 2-metylpropan. Källa: Gabriel Bolívar. Den här gången kan det inte längre skrivas eller representeras i samma rad. Dessa två isomerer delar samma molekylformel: c4H10, som inte tjänar till att diskriminera varandra.
Pentano
Vi har en annan alkan igen: Pentan, vars molekylformel är c5H12. Den halvutvecklade formeln för n-Pentano är ch3-Ch2-Ch2-Ch2-Ch3, Lätt att representera och tolka, utan att behöva placera C-H-länkarna. Grupperna ch3 De är den så kallade metylen eller metylen och valen2 De är metylen.
Pentan har andra grenade strukturella isomerer, som observeras i den nedre bilden representerad av deras respektive halvutvecklade formler:
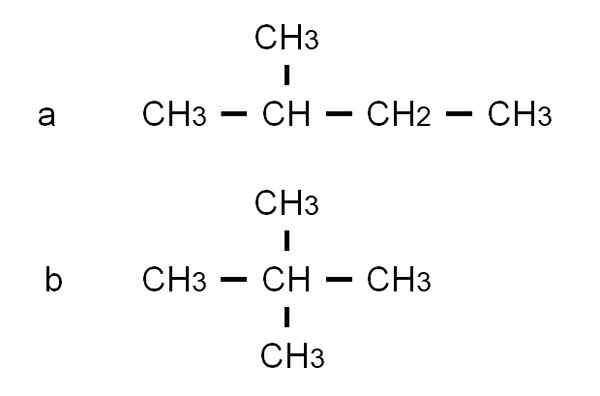 Halvutvecklade formler av de två grenade isomererna i Pentan. Källa: Gabriel Bolívar.
Halvutvecklade formler av de två grenade isomererna i Pentan. Källa: Gabriel Bolívar. Isomeren till Det är 2-metylbutanen, även kallad isopentano. Under tiden isomeren b Det är 2,2-dimetylpropan, även känd som Neopentano. Dess halvutvecklade formler klargör skillnaden mellan de två isomererna; Men han säger inte så mycket om hur sådana molekyler skulle se ut i rymden. För att göra detta skulle strukturella formler och modeller ta.
Kan tjäna dig: sulfonsyra: struktur, nomenklatur, egenskaper, användningarEtanol
Halvutvecklade formler används inte bara för alkaner, alkener eller alkyner, utan för alla typer av organiska föreningar. Således har etanol, en alkohol, en halvutvecklad formel: ch3-Ch2-Åh. Observera att en C-O-länk nu är representerad, men inte O-H-länken. Alla vätebindningar föraktas.
Linjära alkoholer är lätta att representera precis som alkaner. Sammanfattningsvis: Alla halvutvecklade formler av linjära molekyler är lätta att skriva.
Dimetylé
Etrarna kan också representeras med halvutvecklade formler. När det gäller dimetyléer, vars molekylformel är c2H6Eller, den halvutvecklade är: cho3-O-ch3. Observera att dimetyléer och etanol är strukturella isomerer, eftersom de delar samma molekylformel (berätta atomerna i C, H och O).
Cyklohexan
Halvutvecklade formler för grenade föreningar är mer tråkiga att representera än linjära; Men det finns fortfarande fler cykliska föreningar, till exempel cyklohexan. Dess molekylformel motsvarar den som för Hexen och dess strukturella isomerer: c6H12, Eftersom den hexagonala ringen räknas som en omättelse.
För att representera cyklohexan ritas en hexagonal ring vid vars toppar metylengrupperna kommer att vara belägna, ch2, Precis som det ses nedan:
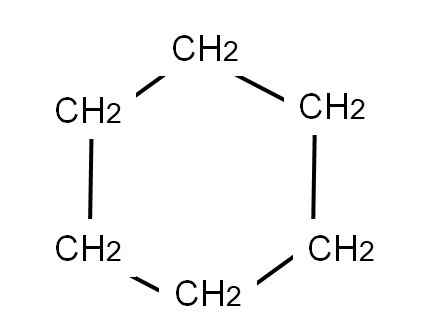 Cyclohexan semi -utvecklad formel. Källa: Gabriel Bolívar.
Cyclohexan semi -utvecklad formel. Källa: Gabriel Bolívar. Den utvecklade formeln för cyklohexanen skulle visa C-H-länkarna, som om ringen hade "antenner" av TV.
Fosforsyra
Den molekylära formeln för fosforsyra är h3Po3. För många oorganiska föreningar räcker molekylformeln för att ha en uppfattning om strukturen. Men det finns flera undantag, och detta är en av dem. Med det faktum att h3Po3 Det är en diplotsyra, den halvutvecklade formeln är: HPO (OH)2.
Kan tjäna dig: neopentil: struktur, egenskaper, nomenklatur, träningDet vill säga en av hydrogenerna är direkt kopplad till fosforatomen. Men formel h3Po3 Den medger också en molekyl med halvutvecklad formel: PO (OH)3. Båda är faktiskt vad som är känt av tautomeres.
Halvutvecklade formler i oorganisk kemi är mycket lik de kondenserade i organisk kemi. I oorganiska föreningar, för att de inte har C-H-bindningar och för att vara enklare räcker deras molekylformler för att beskriva dem (när de är kovalenta föreningar).
Generell kommentar
Halvutvecklade formler är mycket vanliga när eleven lär sig reglerna för nomenklaturen. Men när de väl har assimilerats i allmänhet är kemi -anteckningarna trångt med skelettstrukturella formler; Det vill säga, inte bara C-H-länkarna utelämnas, utan sparar också tid när man ignorerar C.
För resten, i organisk kemi är de kondenserade formlerna mer återkommande än de halvutvecklade, eftersom de förstnämnda inte behöver ens skriva länkarna som i den andra. Och när det gäller oorganisk kemi används dessa halvutvecklade formler mindre.
Referenser
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8: e upplagan.). Cengage Learning.
- Wikipedia. (2020). Halvutvecklad formel. Återhämtad från: är.Wikipedia.org
- Siyavula. (s.F.). Organiska molekylstrukturer. Återhämtat sig från: siyavula.com
- Jean Kim & Kristina Bonnett. (5 juni 2019). Ritning av organiska strukturer. Kemi librettexts. Återhämtad från: kem.Librettexts.org
- Lärare. Marl och JLA. (s.F.). Introduktion till kolföreningar. [Pdf]. Hämtad från: ipn.mx
- « Hållbar konsumtion för vad som används, betydelse, åtgärder, exempel
- Reversibla reaktionsegenskaper och exempel »

