Van der Waals styrkor
- 1262
- 267
- PhD. Emil Svensson
Vi förklarar vad van der Waals är krafterna, deras egenskaper, typer och ger exempel i varje
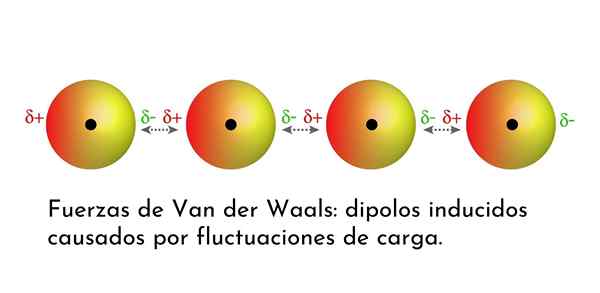
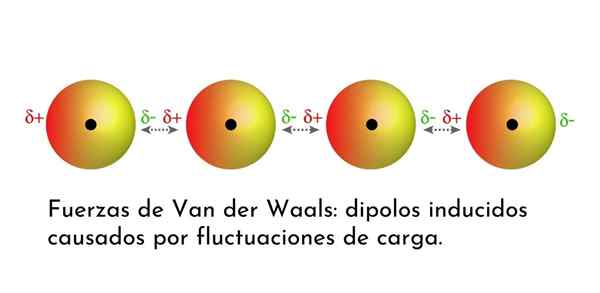 Illustration som visar en av Van der Waals typer av styrkor, Londons spridningskrafter, bland flera atomer med omedelbar dipol
Illustration som visar en av Van der Waals typer av styrkor, Londons spridningskrafter, bland flera atomer med omedelbar dipol Vad är van der Waals styrkor?
De Van der Waals styrkor De är en uppsättning korta attraktionskrafter mellan alla atomer och molekyler. De får sitt namn för att hedra den holländska forskaren Johannes Diderik van der Waals.
Dessa krafter är relativt svaga, men förekommer på hela kontaktytan mellan två atomer, mellan två molekyler eller mellan två ytor, så om den nämnda kontaktytan är stor kan van der Waals krafter bli betydande.
Förståelsen av van der Waals styrkor tillåter kvalitativt förutsäga många fysiska egenskaper hos kemiska ämnen, såsom deras smält- och kokpunkter och löslighet i olika typer av lösningsmedel. Dessa är de krafter som gör det möjligt att förklara hur det är möjligt att en monoatomisk gas som helium, som inte bildar någon typ av kemisk bindning, kan kondensera och flytta till flytande tillstånd.
Dessa krafter förklarar också varför ett ämne som vatten, som bildas av molekyler vars molmassa bara är 18 g/mol, är flytande, medan klor, som väger nästan fyra gånger mer, är en gas vid rumstemperatur.
Egenskaper hos van der Waals styrkor
Förutom att representera en typ av attraktionskraft mellan atomer och molekyler, delar van der Waals krafter inte många egenskaper med kemiska bindningar. Därefter presenteras de mest framstående egenskaperna hos denna typ av krafter:
- De är krafter beroende på avståndet. I det enklaste fallet minskar de med kvadratet på avståndet. Dessutom beror de starkt på molekylgeometri.
- Jämfört med attraktionskrafterna som förekommer i joniska, kovalenta och metalliska länkar är van der Waals krafter relativt svaga.
- Med undantag av dipol-dipolo-interaktioner är de oberoende temperaturinteraktioner.
- De är korta krafter, vilket innebär att de avvisar snabbt när atomer och molekyler rör sig bort.
- De är allmänna krafter som förekommer mellan någon atom och någon molekyl.
- Till skillnad från kovalenta bindningar har de ingen riktning. Detta innebär att oavsett orientering som två molekyler närmar sig, om de närmar sig tillräckligt, kommer van der Waals styrkor alltid att visas.
- När två molekyler eller atomer närmar sig för mycket blir kraften avvisande, vilket förhindrar molekylerna från att kollapsa varandra.
- De är tillsatser, vilket innebär att trots att de är betydligt svaga kan förekomsten av många samtidiga interaktioner orsaka att den totala attraktionskraften är betydande.
Typer av van der Waals styrkor
Förutom den avvisande komponenten som säkerställer att atomer och molekyler inte kollapsar finns det tre typer av van der Waals -krafter, som kanske eller inte kan verka samtidigt mellan två molekyler eller atomer. Dessa presenteras nedan:
1. Dipolo-Dipolo-interaktioner eller Keesom-krafter
Keesoms styrka är en av skattebetalarna till styrkan från Van der Waals. Dessa är de elektrostatiska interaktionskrafterna som förekommer bland de permanenta dipolerna för de polära molekylerna såsom vatten, aceton och andra.
Keesoms krafter liknar elektrostatiska krafter mellan joner, men skiljer sig från dessa genom att de är mycket svagare och förfaller med den sjätte avståndets kraft (det vill säga med R6). Anledningen till att de är svagare är att attraktionen inträffar mellan de partiella belastningarna av en dipol, istället för hela elektriska laddningar som i fallet med joner.
Dessa interaktioner ges endast mellan molekyler och inte mellan atomer, eftersom atomer inte har permanenta dipolmoment. Dessutom är Keesoms kraft omvänt proportionell mot temperaturen, vilket innebär att när den ökar minskar Keesoms styrka.
Exempel på molekyler som har dipol-dipolo-interaktioner
Alla polära molekyler har dipol-dipolinteraktioner mellan dem. Till exempel:
- Två acetonmolekyler.
- Två kloroformmolekyler.
- En cyklohexanonmolekyl med en acetonmolekyl.
2. Inducerade dipolo-dipolo-interaktioner eller Debye Forces
När en polär molekyl närmar sig en atom eller en apolär molekyl, lockar eller upprepar de första dipolen elektroner på ytan av den andra. Detta inducerar en dipol i den apolära molekylen, som kallas inducerad dipol. Den nya dipolen bildades och interagerar sedan med den ursprungliga dipolen och skapar en liten attraktionskraft.
Kan tjäna dig: förbränningsvärmeDessa interaktioner mellan en permanent och inducerad dipol kallas vanligtvis Debye -krafter, och beror inte bara på avståndet mellan de två molekylerna eller mellan den polära molekylen och en individuell atom, utan beror också på polariserbarheten hos apolär molekyl och av storleken på storleken av den polära molekylens dipolmoment.
Exempel på molekyler som har inducerat dipol-dipolinteraktioner
Denna typ av interaktioner ges endast mellan olika molekyler, eftersom den ena behövs för att vara polär och att den andra inte gör. Några exempel är:
- En atom av en ädel gas som argon och en polär förening såsom väteklorid. I detta fall lockar den positiva partiella belastningen i HCl -väte Valencia -elektronerna i argon, vilket genererar en liten dipol inducerad i den senare. Om en argon närmar sig kloratomen kommer den negativa partiella belastningen att avvisa valenselektronerna och en inducerad dipol bildas också.
- Molekylbrominatet (Br2) Det är betydligt lösligt i vatten, trots att det är en apolär förening och vattnet i ett starkt polärt lösningsmedel. Förklaringen beror delvis på den höga polariserbarheten av brom som gör att du kan bilda betydligt starka interaktioner.
3. Inducerad dipolo-dipolo inducerade interaktioner eller London-dispersionskrafter
Av alla van der Waals styrkor är de svagaste Londons dispersionsstyrkor. Dessa interaktioner ges mellan alla atomer och molekyler på grund av utseendet på omedelbara dipoler i någon del av deras struktur.
En omedelbar dipol är en liten dipol som bildas av en asymmetrisk fördelning av valenselektroner vid en given tidpunkt.
Kan tjäna dig: omättade kolvätenHur genereras omedelbara dipoler?
Eftersom elektroner kretsar kring kärnan kan det hända att det på en gång finns fler elektroner på ena sidan än från den andra, vilket ger upphov till en dipol. Denna lilla dipol försvinner snabbt när elektronerna fortsätter att röra sig runt kärnan, och det är därför de kallas ögonblicksbilder.
Omedelbara dipoler kan uppstå var som helst i strukturen för en molekyl och vid varje given tidpunkt kan det finnas många av dem. London -spridningskrafter består av interaktionen mellan dessa omedelbara tider i en molekyl och de av en annan.
Exempel på föreningar som har Dispersion Forces i London
Som nämnts förekommer dessa typer av interaktioner mellan alla atomer och molekyler. Det är emellertid i de stora apolära molekylerna där dess effekt kan observeras bättre, eftersom det i dessa fall är den enda typen av intermolekylär interaktion som inträffar.
Ett typiskt exempel där dessa krafter är mycket intensiva är i fallet med alifatiska kolväten med lång kedja, särskilt i polymerer såsom polyeten.

