Idealisk gasmodell, beteende, exempel
- 4026
- 1051
- PhD. Lennart Johansson
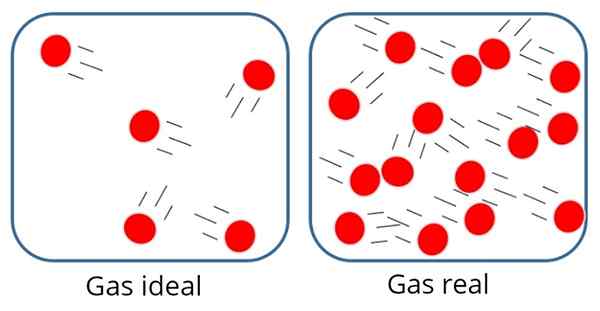
En Idealgas antingen Perfekt gas Det är en där attraktionskraften eller molekylär avstötning anses vara obetydlig mellan partiklarna som komponerar den, därför är all dess inre energi kinetisk, det vill säga energi associerad med rörelsen.
I en sådan gas är partiklarna vanligtvis ganska långt från varandra, även om de ibland kolliderar med varandra och med containerens väggar.
 I den perfekta gasen är partiklarna borta från varandra
I den perfekta gasen är partiklarna borta från varandra Å andra sidan, i den perfekta gasen spelar inte storleken eller massan på partiklarna, eftersom den volym som dem ockuperas är tänkt att vara mycket liten jämfört med själva gasvolymen.
Detta är naturligtvis bara ett tillvägagångssätt, för i verkligheten finns det alltid en viss grad av interaktion mellan atomer och molekyler. Vi vet också att partiklarna upptar utrymme och har massa.
Dessa antaganden fungerar emellertid ganska bra i många fall, till exempel gaser med låg molekylvikt, i ett bra tryck och temperaturer.
Gaser med hög molekylvikt, särskilt vid höga tryck eller låga temperaturer, uppför sig emellertid inte alls som idealiska gaser och behöver andra modeller skapade i syfte att beskriva dem med större precision.
[TOC]
Första experiment
Lagarna som styr gaser är empiriska, det vill säga de uppstod från experiment. De mest anmärkningsvärda experimenten genomfördes under sjuttonde, artonde och tidiga 1800 -talet.
Först är de av Robert Boyle (1627-1691) och Edme Mariotte (1620-1684), som självständigt ändrade tryck i en gas och registrerade sin byte av volym, Upptäcker att de var omvänt proportionella: vid större tryck, mindre volym.
 Robert Boyle
Robert Boyle För hans del konstaterade Jacques Charles (1746-1823) den volymen och temperatur absoluta var direkt proportionella, så länge trycket förblev konstant.
Det kan tjäna dig: stationära vågor: formler, egenskaper, typer, exempelAmadeo Avogadro (1776-1856) upptäckte att två identiska volymer av olika gaser innehöll samma mängd partiklar, så länge trycket och temperaturen var densamma. Och slutligen Joseph de Gay Lussac (1778-1850), sa att genom att hålla volymen fixerad är trycket i en gas direkt proportionell mot temperaturen.
Lagarna om idealiska gaser
Dessa upptäckter uttrycks genom enkla formler, kallar p till trycket, V till volym, n till antalet partiklar och T Den perfekta gastemperaturen:
Boyle-Maleotte Law
Förutsatt att temperaturen är fixerad inträffar följande:
P⋅v = konstant
Charles Law
När gasen är under konstant tryck:
V / t = konstant
Gay lussac lag
Att hålla gasen i en fast volym är sant att:
p / t = konstant
Avogadrolag
Identiska gasvolymer, under samma tryck och temperaturförhållanden har samma antal partiklar. Därför kan vi skriva:
V ∝ n
Där n är antalet partiklar och ∝ är symbolen för proportionalitet.
Idealgasmodell
Den ideala gasmodellen beskriver en gas så att:
-När partiklarna interagerar gör det under mycket kort tid genom elastiska sammanstötningar, där drivkraften och kinetiska energin bevaras.
-Dess beståndsdel är punktliga, med andra ord är dess diameter mycket lägre än det genomsnittliga avståndet de reser mellan en och en annan kollision.
-Intermolekylära krafter är obefintliga.
-Kinetisk energi är proportionell mot temperaturen.
Monoatomiska gaser - vars atomer inte är kopplade till varandra - och låg molekylvikt, i standardförhållanden för tryck och temperatur (atmosfärstryck och 0 º C -temperatur) har de ett sådant beteende att den ideala gasmodellen är en mycket bra beskrivning för dem.
Det kan tjäna dig: Vy Canis Majoris: Discovery, Egenskaper, struktur, träning och utvecklingIdealisk gasstatusekvation
Lagarna i gaserna ovan kombineras för att bilda den allmänna ekvationen som styr det ideala gasbeteendet:
V ∝ n
V ∝ t
Därför:
V ∝ n⋅t
Dessutom av Boyles lag:
V = konstant / p
Då kan vi bekräfta det:
V = (konstant x n⋅t) / p
Konstanten kallas gaskonstant Och det betecknas med bokstaven r. Med detta val relaterar den ideala gasekvationen fyra variabler som beskriver gasstillståndet, nämligen n, r, p och t, lämnar:
P⋅v = n⋅r⋅t
Denna relativt enkla ekvation överensstämmer med lagarna om idealiska gaser. Om till exempel temperaturen är konstant reduceras ekvationen till Boyle-Maleotte-lagen.
Gaskonstanten
Som vi har sagt tidigare, i standardtemperatur och tryckförhållanden, det vill säga vid 0 ° C (273.15 K) och 1 tryckatmosfär, beteendet hos många gaser ligger nära den perfekta gasen. Under dessa förhållanden är volymen 1 mol gas 22.414 L.
Isåfall:
R = (p⋅v) / (n⋅t) = (1 atm x 22.414 L) / (1 mol x 273.15 K) = 0.0821 ATM ⋅ l /mol ⋅ K
Gaskonstant kan också uttryckas i andra enheter, till exempel i det internationella systemet om det är värt:
R = 8 314 J⋅ Mol-1⋅ K-1
När ett problem löses genom den ideala gaslagen är det bekvämt att uppmärksamma de enheter där konstanten uttrycks, eftersom det som vi kan se, det finns många möjligheter.
Beteende hos en idealisk gas
Som vi har sagt uppför sig alla gaser i standardtryck och temperaturförhållanden som är låg molekylvikt, mycket nära den perfekta gasen. Därför är ekvationen p⋅v = n⋅r⋅t tillämplig för att hitta förhållandet mellan de fyra variablerna som beskriver det: n, p, v och t.
Det kan tjäna dig: Heisenberg Atomic ModelPå detta sätt kan vi föreställa oss en idealisk gasdel som är låst i en behållare och bildas av små partiklar, som ibland kolliderar med varandra och med väggarna i behållaren, alltid elastiskt.
Detta är vad vi ser i följande animation av en heliumdel, en ädel och monoatomisk gas:
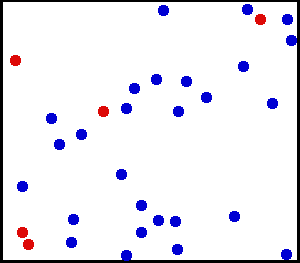 Helium är en ädel gas, i animation visas en del av heliumatomer i en behållare. De röda tjänar till att bättre skilja rörelse. Källa: Wikimedia Commons.
Helium är en ädel gas, i animation visas en del av heliumatomer i en behållare. De röda tjänar till att bättre skilja rörelse. Källa: Wikimedia Commons. Exempel på idealiska gaser
En idealisk gas är en hypotetisk gas, det vill säga det är en idealisering, men i praktiken uppför sig många gaser på ett mycket nära sätt, vilket gör det möjligt för P⋅V -modellen = n⋅r⋅t exakt.
ädelgaser
Exempel på gaser som uppför sig som ideal under standardförhållanden är ädla gaser, liksom lätta gaser: väte, syre och kväve.
Den aerostatiska ballongen
 Den ideala gasmodellen förklarar hur luftballongen. Källa: Wikimedia Commons.
Den ideala gasmodellen förklarar hur luftballongen. Källa: Wikimedia Commons. Till den aerostatiska ballongen i figur 1 kan tillämpas med Charles lag: gasen värms upp, därför expanderar luften som fyller världen och som en följd av det stiger den.
Heliumballonger
Helium är, tillsammans med väte, det vanligaste elementet i universum, och ändå är det knappt på jorden. Eftersom en ädel gas är inert, till skillnad från väte, så används helium full ballonger allmänt som dekorativa element.
Referenser
- Atkins, s. 1999. Fysisk kemi. Omega -utgåvor.
- Chang, R. 2013. Kemi. 11VA. Utgåva. MC Graw Hill Education.
- Cengel och. 2012. Termodynamik. Sjunde upplagan. McGraw Hill.
- Cimbala, c. 2006. Mekanik för vätskor, grundläggande faktorer och applikationer. Mc. Graw Hill.
- Giambattista, a. 2010. Fysik. 2: a. Ed. McGraw Hill.
- « Naturliga miljöegenskaper, element, betydelse, exempel
- Appellativa funktionsexempel och egenskaper »

