Heliohistoria, egenskaper, struktur, risker, användningar

- 966
- 194
- Erik Eriksson
han helium Det är ett kemiskt element vars symbol är. Detta är den första ädla gasen i det periodiska bordet och är vanligtvis beläget i slutet av samma. Under normala förhållanden är det en inert gas, eftersom ingen av dess få föreningar är stabil; Det expanderar också mycket snabbt och är ämnet med den minsta kokpunkten för alla.
På populärnivå är det en välkänd gas, eftersom det i otaliga evenemang eller barnfester är vanligt. Men vad som verkligen och för evigt går förlorat mot solsystemets hörn, och därefter är de heliumatomerna som släpps när världen är uppdelad.
 Ballonger uppblåsta med helium, det närmaste som kan vara av detta element i vardagliga situationer. Källa: Pixabay.
Ballonger uppblåsta med helium, det närmaste som kan vara av detta element i vardagliga situationer. Källa: Pixabay. I själva verket finns det de som, och med stor anledning, tror att heliumballonger representerar en olämplig praxis för denna gas. Lyckligtvis har den viktigare och intressanta användningar tack vare dess fysiska och kemiska egenskaper som skiljer den från andra kemiska element.
Till exempel är flytande helium så kallt att det kan frysa vad som helst, som en metalllegering, vilket gör det till ett superledarmaterial. Det är också en vätska som manifesterar superfluiditet, som kan klättra på väggarna i en glasbehållare.
Hans namn beror på att han först identifierades i solen och inte på jorden. Det är det näst vanligaste elementet i hela universum och även om dess koncentration är löjlig i jordskorpan, kan det erhållas från reserverna för naturgas och radioaktiva mineraler av uran och thorium.
Här demonstrerar heliet ytterligare ett nyfiken faktum: det är en gas som överflödar mycket mer i undergrunden än i atmosfären, där det slutar fly från jorden och dess gravitationsfält.
[TOC]
Historia
Helium upptäcktes inte på jorden utan i solen. Faktum är att hans namn kommer från det grekiska ordet 'helios' som betyder sol. Förekomsten av elementet enbart kontrasterade den periodiska tabellen för Dmitri Mendeléyev, eftersom det inte fanns någon plats för en ny gas; det vill säga, då fanns det absolut ingenting om ädla gaser.
Namnet 'Helio', skrivet som 'Helium' på engelska, slutade med suffixet -ium som hänvisade till det som en metall; Precis för att förekomsten av en annan gas bortsett från syre, väte, fluor, klor och kväve inte kunde tillåtas.
Detta namn utsågs av den engelska astronomen Norman Lockyer, som studerade från England vad som observerades av French Astronom.
Det var en gul spektral linje av ett okänt element fram till dess. Lockyer sa att detta berodde på närvaron av ett nytt kemiskt element som finns i solen.
1895, nästan tjugo år senare, erkände den skotska kemisten Sir William Ramsay samma spektrum från en återstående gas när han studerade ett radioaktivt mineral: Cleveíta. Det var därför helio här också.
Fysiska och kemiska egenskaper
Utseende
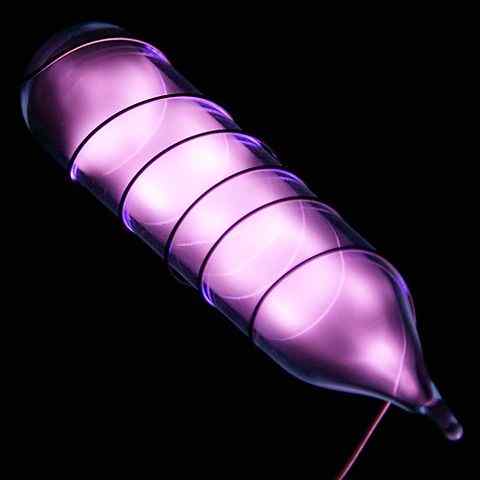 Ampull med ett heliumprov som lyser efter en elektrisk chock. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]
Ampull med ett heliumprov som lyser efter en elektrisk chock. Källa: Hi-reser Bilder av kemiska element [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] Helium är en färglös, luktfri gas, som inte har någon smak och är också inert. Men när en elektrisk chock appliceras, och beroende på spänningsskillnaden, börjar den lysa som en gråaktig moral dimma (övre bild), för att sedan lysa med en orange glöd. Därför är heliumljus orange.
Atomantal (z)
2
Molmassa
4,002 g/mol
Smältpunkt
-272.2 ºC
Kokpunkt
-268,92 ºC
Densitet
-0,1786 g/L, under normala förhållanden, det vill säga i en gasfas.
-0,145 g/ml, vid smältpunkten, den flytande helium.
-0,125 g/ml, precis när helium börjar koka.
-0,187 g/ml, vid 0 k och 25 atm, det vill säga fast helium till de specifika tryck- och temperaturförhållandena.
Trippelpunkt
2,177 K och 5,043 kPa (0,04935 ATM)
Kritisk punkt
5,1953 K och 0,22746 MPa (2,2448 atm)
Fusionsvärme
0,0138 kJ/mol
Förångningsvärme
0,0829 kJ/mol
Molvärmekapacitet
20,78 J/(mol · k)
Ångtryck
0,9869 ATM vid 4,21 K. Detta värde tjänar till att ge en uppfattning om hur flottan.
Joniseringsenergier
-Först: 2372,3 kJ/mol (han+ gasformig)
-Andra: 5250,5 kJ/mol (han2+ gasformig)
Joniseringsenergier för helium är särskilt höga eftersom gasatomen måste förlora en elektron, som upplever en stark effektiv kärnbelastning. Det kan också förstås om atomens lilla storlek beaktas och hur "nära" är de två elektronerna med avseende på kärnan (med sina två protoner och två neutroner).
Löslighet
I vattnet upplöstes 0,97 ml per 100 ml vatten vid 0 ºC, vilket innebär att det är lite lösligt.
Kan tjäna dig: ammoniumoxalatReaktivitet
Helium är det näst minst reaktiva kemiska elementet i naturen. Under normala förhållanden är det framgångsrikt att bekräfta att det är en inert gas; Aldrig (för vad det verkar) kan manipuleras en heliumförening i ett rum eller laboratorium utan enorma tryck som verkar på det; eller kanske dramatiskt höga eller låga temperaturer.
Ett exempel vi ser i NA -föreningen2Han, som är stabil endast under ett tryck av 300 GPa, reproducerad i en diamant yunque cell.
Medan de kemiska bindningarna i NA2Har "främlingar" för att ha sina elektroner väl belägna i kristallerna, de är långt ifrån enkla interaktioner mellan van der väggar och därför består det inte bara av heliumatomer som fångas av molekylaggregat. Det är här dilemmaet mellan vilka heliumföreningar är verkliga och vilka inte.
Till exempel kan kvävemolekyler till högt tryck fängsla en heliumatom för att orsaka en slags klump2)elva.
Det finns också endo -underverkskomplex av fullerenkatjoner, c60+n och C70+n, i vars håligheter de kan hysa heliumatomer; och molekylkatjonen heh+ (He-H+), finns i mycket avlägsna nebulor.
Oxidationsnummer
Vem av nyfikenhet försöker beräkna oxidationsnumret för helium i någon av dess föreningar kommer att upptäcka att detta är lika med 0. I NA2Han kunde till exempel tänka på att hans formel motsvarar hypotetiska najoner2+han2-; Men sådant skulle vara att anta att han har en ren jonisk karaktär, när hans länkar i verkligheten är långt ifrån.
Dessutom vinner Helium inte elektroner eftersom det inte kan rymma dem i 2S -omloppet, otillgänglig energi; Och inte heller är det möjligt att du förlorar dem på grund av den minskade storleken på dess atom och den stora effektiva kärnbelastningen i dess kärna. Det är därför helium alltid deltar (i teorin) som en atom0 I dess härledda föreningar.
Elektronisk struktur och konfiguration
Helium, som alla gaser som observerats i en makroeskala, upptar volymen på containrarna som lagrar den och därmed har ett obestämt sätt. Men när temperaturen sjunker och börjar svalna under -269 ºC, kondenseras gasen i en färglös vätska; Helium I, den första av de två flytande faserna för detta element.
Anledningen till att helium kondenserar vid en så låg temperatur beror på de få spridningskrafterna som håller sina atomer ihop; Oavsett vilken fas som övervägs. Detta kan förklaras från dess elektroniska konfiguration:
1s2
Där två elektroner upptar 1s atomorbital. Heliumatom kan visualiseras som en nästan perfekt sfär, vars homogena elektroniska periferi inte är särskilt benägna att polarisera av den effektiva kärnbelastningen för de två protonerna i kärnan.
Således är spontana och inducerade dipolmoment ovanliga och mycket svaga; Så temperaturen måste närma sig den absoluta nollet så att atomerna har närmade sig tillräcklig långsamhet och göra att deras spridande krafter definierar en vätska; Eller ännu bättre, ett heliumglas.
Dimers
I gasfasen har utrymmet som skiljer atomerna sådant att det kan antas att en av de andra alltid är separerade. Så mycket att i en blister, med liten volym ser heliumet färglös ut tills den utsätts för en elektrisk chock, som joniserar sina atomer i en gråaktig och liten ljus dimma.
Men i vätskefasen har atomerna, även med sina svaga interaktioner, de kan inte längre "ignorera" under en längre tid. Nu tillåter spridningsstyrkan dem2. Därför kan du tänka på helium i som stora kluster av han2 i balans med sina ångfasatomer.
Det är därför Helium I är så svårt att skilja från dess ångor. Om denna vätska spillas utanför sin hermetiska behållare flyr den som en vitaktig flare.
Helio ii
När temperaturen sjunker ännu mer, berör på 2 178 K (-270 972 ºC), inträffar en fasövergång: Helium I förvandlas till helium II.
Från denna punkt blir den fascinerande heliumvätskan en överflödig eller kvantvätska; Det vill säga dess makroskopiska egenskaper manifesteras som om dimererna2 De var enskilda atomer (och kanske de är). Det saknar fullständig viskositet, eftersom det inte finns någon yta som kan stoppa en atom under dess glidning eller "klättring".
Det är därför Helio II kan stiga genom väggarna i en glasbehållare som övervinner tyngdkraften; Oavsett hur höga de är, så länge ytan förblir vid samma temperatur och därför inte flyktig.
Det kan tjäna dig: hypofysyra (H3PO2): egenskaper, användningar och reagensPå grund av detta kan den flytande helium inte förvaras i glasbehållare, eftersom den skulle fly före den minsta sprickan eller kryphålen; Mycket lik hur skulle det hända med en gas. Istället används rostfritt stål för att designa dessa containrar (dewars tankar).
Kristaller
Även om temperaturen kom ner till 0 K (den absoluta noll), skulle spridningskraften mellan atomerna inte vara tillräckligt stark för att beställa dem i en kristallin struktur. För att göra stelning måste trycket öka till cirka 25 atm; Och sedan visas kompakta hexagonala kristaller (HCP).
Geofysiska studier visar att denna HCP -struktur förblir oförändrad överlägset att trycket ökas (upp till Pascal Giga, GPA) upp till Pascal Giga, GPA). Det finns emellertid en smal region i sitt trycktemperaturdiagram där dessa HCP-kristaller lider av en övergång till en kubisk fas centrerad på kroppen (BCC).
Var är det och få
Kosmos och stenar
 Helium representerar det näst vanligaste elementet i universum och 24% av dess massa. Källa: Pxhere.
Helium representerar det näst vanligaste elementet i universum och 24% av dess massa. Källa: Pxhere. Helium är det näst vanligaste elementet i hela universum, överträffat endast av väte. Stjärnorna producerar ständigt oändliga mängder heliumatomer genom att fusionera två vätekärnor under nukleosyntesprocessen.
På samma sätt är alla radioaktiv processer som avger a -partiklar en källa för produktion av heliumatomer om de interagerar med miljöens elektroner; Till exempel med en bergkropp i tankar av radioaktiva mineraler av uran och thorium. Dessa två element lider av radioaktivt förfall, börjar med uran:
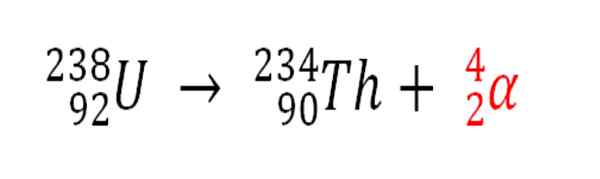 Radioaktivt förfall i uran i bildningen av Alfas -partiklar, som därefter förvandlas till heliumatom i underjordiska avlagringar. Källa: Gabriel Bolívar.
Radioaktivt förfall i uran i bildningen av Alfas -partiklar, som därefter förvandlas till heliumatom i underjordiska avlagringar. Källa: Gabriel Bolívar. Därför, i klipporna där dessa radioaktiva mineraler är koncentrerade, kommer heliumatomer att fångas, som kommer att släppas när de smälts i sura media.
Bland några av dessa mineraler är Cleveíta, Carnotita och Uraninite, alla sammansatta av uranoxider (UO2 eller u3ANTINGEN8) och föroreningar av thorium, tungmetaller och sällsynta jordar. Heliumet, bevattnat genom underjordiska kanaler, kan hamna på att samlas i naturgasreservoarer, mineralfjädrar eller i meteoriska strykjärn.
Det uppskattas att en heliummassa motsvarande 3000 ton produceras årligen, från radioaktivt förfall av uran och thorium.
Luft och hav
Helium är inte särskilt löslig i vattnet, så förr snarare än senare hamnar den upp från djupet (där dess ursprung finns), för att korsa atmosfärens lager och slutligen nå det sidereala utrymmet. Dess atomer är så små och lätta att jordens gravitationsfält inte kan behålla dem i atmosfären.
På grund av ovanstående är koncentrationen av helium både i luften (5,2 ppm) och i havet (4 ppt) mycket låg.
Om du ville extrahera från något av dessa två medier, skulle det "bästa" alternativet vara luften, som först skulle behöva skicka in den till kondensering för att kondensera alla dess komponentgaser, medan heliumet förblir i ett gasformigt tillstånd.
Det är emellertid inte praktiskt att få helium från luften, utan från klipporna berikade med radioaktiva mineraler; eller ännu bättre, av naturgasreserver, där helium kan representera upp till 7% av dess totala massa.
Naturgas flytande och destillation
Istället för att underkastas luften är det enklare och mer lönsamt. Således är råmaterialet Par Excellence (kommersiell) för att få helium naturgas, som också kan skickas till fraktionerad destillation.
Den slutliga produkten av destillation är klar med aktivt kol, som passerar genom en stor renhetshelium. Och slutligen separerar Helium från neon genom en kryogen process där flytande helium används.
Isotoper
Helium presenteras i naturen främst som isotopen 4Han, vars nakna kärna är den berömda partikeln a. Denna atom av 4Jag har två neutroner och två protoner. I mindre överflöd är isotopen 3Han, som bara har en neutron. Den första är tyngre (den har en större atommassa) än den andra.
Således isotopparet 3Han och 4Har är de som definierar de messtekta egenskaperna och vad vi förstår av helium som ett kemiskt element. Sedan den 3Han är lättare, det antas att deras atomer har mer kinetisk energi och att de därför behöver en ännu lägre temperatur för att sammanhålla i en överflödig.
han 3Jag har betraktat en mycket sällsynt art här på jorden; Men i månjord är det mer rikligt (ungefär 2000 gånger). Det är därför månen har varit föremål för projekt och berättelser som en möjlig källa till 3Han, som kan användas som ett kärnbränsle för framtidens rymdskepp.
Kan tjäna dig: rena ämnenBland andra heliumisotoper kan nämnas, med deras respektive halva livstid: 5HAN (t1/2= 7,6 · 10−22 s), 6HAN (t1/2= 0,8 s) och 8HAN (t1/2= 0,119 s).
Risker
Helium är en inert gas och deltar därför inte i någon av de reaktioner som förekommer i våra kroppar.
Dess atomer kommer praktiskt taget in och andas ut utan deras interaktion med biomolekyler som ger en efterföljande effekt; Förutom i ljudet som släpps ut från stämbanden, som blir mer akuta och har mer frekvens.
Människor som andas in Helio av en ballong (med mått), pratar med en akut röst, liknande den för en ekorre (eller anka).
Problemet ligger i det faktum att om nämnda person inandas en olämplig mängd helium, risken för kvävande körningar, eftersom deras atomer flyttar till syremolekyler; Och därför kommer det inte att kunna andas förrän all den heliumen utandas, vilket i sin tur på grund av dess tryck kan riva lungvävnaden eller orsaka barotraumas.
Fall av människor som har dött av inhalation Helio har rapporterats på grund av de nyligen förklarade.
Å andra sidan, även om den inte representerar en brandrisk med tanke på dess brist på reaktivitet mot syre (eller annat ämne), om det lagras under högt tryck och fly, kan dess flykt vara fysiskt farligt.
Ansökningar
Helios fysiska och kemiska egenskaper gör det inte bara till en speciell gas, utan också ett mycket användbart ämne för applikationer som förtjänar temperaturer i extremt låg. I det här avsnittet kommer några av dessa ansökningar eller användningar att behandlas.
Tryck- och rensningssystem
I vissa system är det nödvändigt att öka trycket (tryck), och för detta måste det injiceras eller levereras som inte interagerar med någon av dess komponenter; Till exempel med reagens eller ytor känsliga för oönskade reaktioner.
Således kan trycket ökas med heliumvolymer, vars kemiska tröghet gör det idealiskt för detta ändamål. Den inerta atmosfären som underlättar överstiger i vissa fall av kväve.
För omvänd process, det vill säga rensning, helium används också på grund av dess förmåga att dra allt syre, vattenångor eller någon annan gas, vars närvaro vill eliminera. På detta sätt reduceras systemtrycket när heliumet har tömts.
Läcktäckt
Helium kan filtreras genom den minsta sprickan, så den tjänar också till att upptäcka läckor i rör, hög -vacuumbehållare eller kryogena tankar.
Ibland kan detektering göras visuellt eller med beröring; Men mestadels är en detektor vad som "kastar" signalen om var och hur mycket helium som flyr från systemet under inspektion.
Draggas
Heliumatomer, som nämnts för rensningssystem, kan dra det, beroende på ditt tryck, tyngre molekyler. Till exempel används denna princip dagligen i gaskromatografanalys, eftersom den kan dra provet atomiserat längs kolumnen, där den interagerar med den stationära fasen.
Ballonger och luftskepp
 Helium används för att blåsa upp luftskeppen och är mycket säkrare än väte eftersom det inte är en brandfarlig gas. Källa: Pixabay.
Helium används för att blåsa upp luftskeppen och är mycket säkrare än väte eftersom det inte är en brandfarlig gas. Källa: Pixabay. På grund av dess låga densitet jämfört med luft och återigen till dess brist på reaktivitet med syre har den använts för att blåsa upp ballonger på barnpartier (blandat med syre så att ingen kvävs för andning) och luftskepp (överlägsen bild) , utan att kunna representera en risk för eld.
Dyka
 Helium är en av de viktigaste komponenterna i syretankarna som dykarna andas in. Källa: Pxhere.
Helium är en av de viktigaste komponenterna i syretankarna som dykarna andas in. Källa: Pxhere. När dykarna går ner till större djup har de svårt att andas till följd av det stora trycket som utövas av vattnet. Det är därför Helio tillsätts i sina syretankar för att minska densiteten på gasen som dykarna andas och andas ut, och därmed kan det andas ut med mindre arbete.
Bågsvetsning
I svetsprocessen ger den elektriska bågen tillräckligt med värme så att de två metallerna förenas. Om den utförs under en atmosfär av helium kommer den glödande metallen inte att reagera med luftens syre för att bli dess respektive oxid; Därför förhindrar helium att detta händer.
Superledare
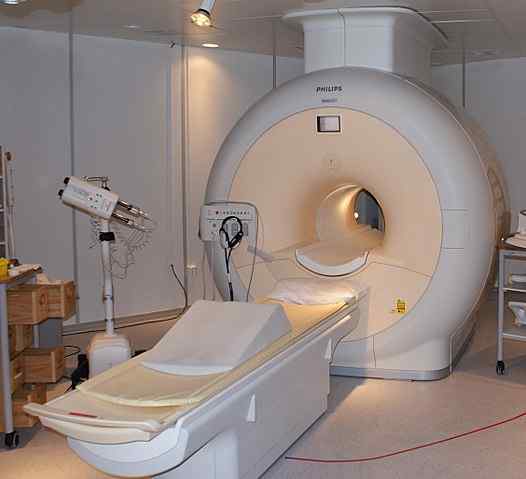 Flytande helium används för att kyla magneterna som används i skannrarna med kärnmagnetisk resonansavbildning. Källa: Jan Ainali [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)]
Flytande helium används för att kyla magneterna som används i skannrarna med kärnmagnetisk resonansavbildning. Källa: Jan Ainali [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] Flytande helium är så kallt att den kan frysa metaller för att förvandla dem till superledare. Tack vare detta har mycket kraftfulla magneter tillverkats, som, kyld med flytande helium, har använts i bilder av bilder eller spektrometrar av kärnmagnetisk resonans.
Referenser
- Shiver & Atkins. (2008). Oorganisk kemi. (Fjärde upplagan). MC Graw Hill.
- Andy Estance. (17 april 2019). Heliumhydridjon upptäckt i rymden för första gången: bevis hittades för svårfångad kemi från universums första minuter. Återhämtat sig från: Chemistryworld.com
- Peter Wothers. (19 augusti 2009). Helium. Kemi i sitt element. Återhämtat sig från: Chemistryworld.com
- Wikipedia. (2019). Helium. Hämtad från: i.Wikipedia.org
- Mao, h. K., Wu och., Jephcoat, a. P., Hemley, r. J., Klocka, s. M., & Bassett, W. TILL. (1988). Kristallstruktur och densitet av helium upp till 232 kbar. Hämtad från: artiklar.Adsabs.Sköre.Edu
- Nationellt centrum för bioteknikinformation. (2019). Helium. Pubchemdatabas. CID = 23987. Återhämtat sig från: pubchem.Ncbi.Nlm.Nih.Gov
- Mary-Ann Muffoletto. (6 februari 2017). Upp, upp och bort: kemister säger "ja," helium kan bilda föreningar. Utah State University. Återhämtat sig från: phys.org
- Steve Gagnon. (s.F.). Isotoper av elementets helium. Jefferson Lab. Återhämtat sig från: utbildning.Jlab.org
- AVAMEG, INC. (2019). Helium. Återhämtat sig från: kemi.com

