Hemoolisinegenskaper, typer, verkningsmekanismer
- 4519
- 1216
- Johan Gustafsson
De Hemoolisin Det är ett litet protein som orsakar porer i cellmembranet i erytrocyter och vissa andra celler av däggdjurs blod. Det syntetiseras i allmänhet och utsöndras av patogena bakterier.
Detta protein är ett av de vanligaste mikrobiella toxinerna och den som bäst har studerats. Ibland kan det orsaka hemolytisk anemi, eftersom mängden kanaler genom vilken cellinredningen kommer ut kan till och med orsaka celllys.
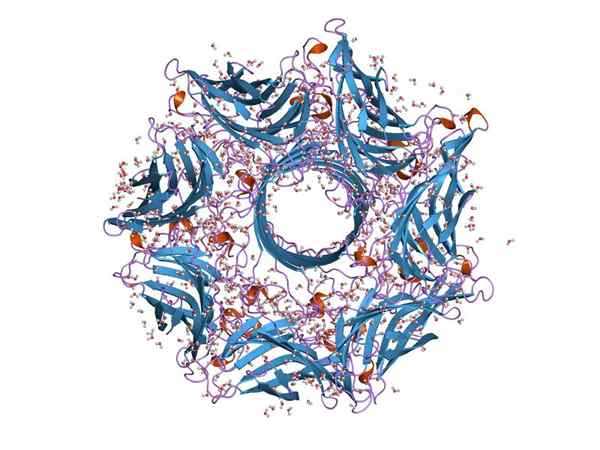
 Molekylär struktur av en hemoolisin (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons)
Molekylär struktur av en hemoolisin (källa: Jawahar Swaminathan och MSD -personal vid European Bioinformatics Institute [Public Domain] via Wikimedia Commons) Generellt sett är hemoolisin ett typiskt toxin av arten av Streptokock av tarmkanalen. Dess funktion gör det möjligt för bakterier att bryta epitelbarriären i tarmkanalen och därmed röra sig genom blodomloppet för att kolonisera andra vävnader.
Det vanligaste sättet på vilket hemoolisin finns i naturen finns i dess a-hemolisinform. Detta protein är en av de viktigaste virulensfaktorerna i de flesta stammar av Escherichia coli Och några Clostrides.
De flesta urinvägsinfektioner orsakas av stammar av Escherichia coli som producerar a-hemolisin med hemolytiska egenskaper.
Produktion av hemoolisin och bakteriocin har varit relaterad till bakteriestammar med en kompetensmekanism mot andra arter och produktionen av båda toxinerna verkar bero på samma genetiska determinanter i bakteriegenomet.
[TOC]
Egenskaper
Hemoolisin utgörs av sju underenheter och genen som kodar för den har sju promotorer. Dessa sju underenheter sätts in i plasmamembranet i de vita cellerna och när de tillsammans bildar en jonisk kanal där metaboliterna i cellinredningen fly.
Hemoolisin är kalciumberoende cytotoxin (Ca+2) extracellulärt som verkar på plasmamembranet i blod torrentceller. Porerna som skapar i membranet är också hydrofila och orsakar inträde av vatten i cellinredningen, vilket kan orsaka lys.
Det kan tjäna dig: Unaporto: Transport genom membran, egenskaperHemoolisiner är proteinprodukter som är typiska för bakterier av gramnegativa typ och alla delar två egenskaper:
1- Närvaron av en mycket liten peptid (nonapéptide) bildad av upprepad glycin och aspartinsyra. Hemoolisin nonapapéptides är belägna nära den C-terminala delen av den primära proteinstrukturen.
2- Alla hemoolisiner utsöndras av bakterien till det extracellulära mediet genom en ABC-typtransportör (från den engelska ATP-bindande kassetten).
Hemoolisiner upptäcks vanligtvis i bakteriestammar genom tillväxt i mitten av blodagar. I testet observeras en hemolytisk gloria, produkten av brottet i de röda blodkropparna nära bakteriekolonierna.
Grabbar
Det finns flera olika typer av hemoolisiner, dessa klassificeras med ett grekiskt brev i början av deras namn. De mest studerade och vanliga är a, p och y hemoolisiner, alla producerade av stam Staphylococcus aureus.
Hemoolisintyper klassificeras enligt intervallet av celler som attackerar och enligt deras primära proteinstruktur.
a-hemolisin
Detta protein är typiskt för stammarna av Staphylococcus aureus och Escherichia coli; Attacks neutrofiler, röda blodkroppar, lymfocyter, makrofager, vuxna och embryonala fibroblaster. Interagera med de polära huvuden på plasmamembranlipiderna i dessa celler tills de internaliserar en hydrofob svans på cirka 5 ӑ inuti membranet.
p
Producerad av Staphylococcus aureus Till en mindre andel än a-hemolisin attackerar ß-hemolisin huvudsakligen erytrocyter och är inre i membranet uteslutande genom rika domäner i sfingomelin i cellmembranet.
y-hemolisin
Det har också observerats i Staphylococcus aureus. Det har klassificerats som ett hemolytiskt protein och leukotoxin samtidigt, eftersom det påverkar polymorfonukleära celler hos människor, monocyter, makrofager och sällan, även till de röda blodkropparna.
Denna typ av y-hemolisin är en av de minst karakteriserade, därför har mycket av dess verkningsmekanism varit okänd och detta har inte undersökts In vivo.
Kan tjäna dig: osteoblaster: Träning, egenskaper, funktioner, patologierHandlingsmekanismer
Handlingsmekanismen som har klargjorts relativt tydlig är den för a-hemolisin. Eftersom alla är hemolytiska proteiner tros emellertid att de flesta processer är vanliga för alla hemolysiner.
Forskare föreslår att de för bakterier separerar hemoolisin till miljön de måste vara i ett näringsämnet -dåliga mikromiljöer, därför skulle detta vara en mekanism som utlöser cellen för att förstöra vita celler och få sina näringsämnen.
Mekanismen har beskrivits i tre steg: föreningen till cellmembranet, införande och oligomerisering.
Membranförening
Det har visat sig att hemoolisiner kan förena integrinerna av neutrofiler och i erytrocyter har det observerats att dessa proteiner binder till glykosylerade komponenter såsom glykoproteiner, gangliasider och cellmembran glyforiner.
Vissa författare föreslår att närvaron av receptorer i membranet inte är nödvändigt för att föreningen av hemolysiner ska inträffa. I vilket fall som helst är mekanismen för rekonnande cellulärt protein ännu inte känt exakt.
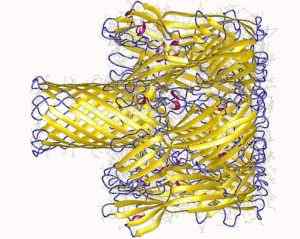 Transmembranal por bildad av Staphylococcus hemoolisinprotein (källa: deponering Författare: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.OCH.; Visualisering Författare: Användare: Astrojan [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] via Wikimedia Commons)
Transmembranal por bildad av Staphylococcus hemoolisinprotein (källa: deponering Författare: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.OCH.; Visualisering Författare: Användare: Astrojan [CC av 3.0 (https: // CreativeCommons.Org/licenser/av/3.0)] via Wikimedia Commons) Interaktionen med membranet förekommer i två steg:
- Initial Union (reversibel): När hemoolisin binder till membrankalciumkorsningsdomänerna. Detta steg inträffar på ytan och är mycket mottaglig för elektrostatiska urladdningar.
- Irreversibel förening: Boka aminosyradomänerna med lipidkomponenterna i det yttre skiktet i plasmamembranet i de vita cellerna för att bilda fysiska fackföreningar mellan de hydrofoba föreningarna i membranet.
Kan tjäna dig: cellväggInförande av toxin i membranet
A-hemolisin sätter in avfall 177 och 411 i det första lipidmonolageret. I det extracellulära mediet är hemoolisin associerat med kalciumjoner, som inducerar ett strukturellt arrangemang i detta och bidrar till dess aktivering.
Denna införande konsoliderar den irreversibla föreningen till cellmembranet. När arrangemanget har inträffat blir hemoolisin ett integrerat protein eftersom det experimentellt har visats att det enda sättet att extrahera det från membranet är genom användning av tvättmedel såsom Triton X-100.
Oligomerisering
När all hemoolisin har lagts in i plasmamembranet i den vita cellen.
Det har observerats att oligomeriseringsprocessen gynnas av mikrodominier eller lipidbalas i cellmembranet. Dessa regioner kanske inte gynnar föreningen mellan proteinet, men de gynnar oligomeriseringen av det en gång satt in.
Ju fler hemoolisiner binder till membranet, desto större kommer mängden porer att bildas. Dessutom kan hemoolisiner oligomerisera med varandra (intilliggande) och bilda mycket större kanaler.
Referenser
- Bakás, L., Ostolaza, h., Vaz, w. L., & Goñi, f. M. (nitton nittiosex). Reversibel adsorption och icke-reversibel införande av Escherichia coli alfa-hemolysin till lipid tvåskikt. Biophysical Journal, 71 (4), 1869-1876.
- Dalla Serra, M., Coraiola, m., Viero, g., Comai, m., Potrich, c., Ferreras, m.,... & Prévot, g. (2005). Staphylococcus aureus bicomponent y-hemolysiner, HLGA, HLGB och HLGC, kan blandas för att räkna alla komponenter. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, j. TILL., & Robinson, J. (1969). Egenskaper hos renad stafylokock ß-hemolysin. Journal of Bacteriology, 97 (3), 1026-1032.
- Ike och., Hashimoto, h., & Clewell, D. B. (1984). Hemolysin från Streptococcus faecalis underperioden Zymogenes Du bidrar till virulens hos möss. Infektion och immunitet, 45 (2), 528-530.
- Remington, J. S., Klein, J. ANTINGEN., Wilson, C. B., Nizet, v., & Maldonado, och. TILL. (Eds.). (1976). Smittsamma öknar från fostret och nyfödda spädbarn (Vol. 4). Philadelphia: Saunders.
- Todd, E. W. (1932). Antigen streptokock hemolysin. Journal of Experimental Medicine, 55 (2), 267-280.
- « Pietrain ursprung, egenskaper, mat, reproduktion
- Anslutande ventiler Egenskaper, histologi, funktioner »

